1. 6 loại bài tập Bảng tuần hoàn trong đề thi Đại học và hướng dẫn giải
Dạng 1: Mối liên hệ giữa vị trí của nguyên tố, cấu tạo nguyên tử và tính chất của hợp chất
Cách giải
- Số thứ tự của nguyên tố = tổng số electron trong nguyên tử.
- Số thứ tự của chu kỳ = số lượng lớp electron.
- Số thứ tự của nhóm:
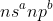
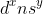
* Nhóm (x + y)B nếu 3 ≤ (x + y) ≤ 7.
* Nhóm VIIIB nếu 8 ≤ (x + y) ≤ 10.
* Nhóm (x + y - 10)B nếu (x + y) > 10.
Dạng 2: So sánh tính chất của các nguyên tố kế cận và hợp chất oxit, hiđroxit của chúng
Phương pháp giải Các đại lượng và tính chất thay đổi theo xu hướng tăng của điện tích hạt nhân:
+ Kích thước nguyên tử
+ Năng lượng ion hóa đầu tiên
+ Độ âm điện của nguyên tố
+ Đặc tính kim loại và phi kim
+ Tính chất axit – bazơ của oxit và hiđroxit
+ Hóa trị cao nhất của nguyên tố với oxi và hóa trị của nguyên tố phi kim với hiđro
Dạng 3: Xác định hai nguyên tố thuộc hai nhóm A liên tiếp
Cách giải
Giả sử ZA < ZB. Nếu A và B nằm trong cùng một chu kỳ, thì: ZA – ZB = 1.
+ Nếu không xác định được A và B có cùng chu kỳ hay không, cần dựa vào = Z/2 và ZA << ZB.
Dạng 4: Xác định hai nguyên tố thuộc cùng một nhóm A
Cách giải
Nếu tổng số hiệu nguyên tử nằm trong khoảng 4 < ZT < 32, thì A và B sẽ thuộc các chu kỳ nhỏ hoặc ZA - ZB = 8.
- Nếu ZT > 32, cần xem xét ba trường hợp khác nhau:
+ A là H.
+ A và B cách nhau 8 đơn vị.
+ A và B cách nhau 18 đơn vị.
Dạng 5: Xác định nguyên tố dựa trên vị trí của nó và tính toán theo phương trình hóa học
Dạng 6: Xác định tên nguyên tố dựa vào công thức oxit cao nhất và công thức hợp chất khí với hiđro
Cách giải
Tổng hóa trị trong hợp chất khí với hiđro (nếu có) và hóa trị trong oxit cao nhất của một nguyên tố bằng 8.
| Nhóm | I | II | III | IV | V | VI | VII |
| Oxit cao nhất | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 |
| Hợp chất với Hidro | RH rắn | RH2 rắn | RH3 rắn | RH4 khí | RH3 khí | RH2 khí | RH khí |
2. Bài tập áp dụng Bảng tuần hoàn hóa học
Bài tập 1: Hai nguyên tố A và B nằm kế tiếp trong cùng một chu kỳ của bảng tuần hoàn, với tổng điện tích hạt nhân là 33. Xác định vị trí của A và B trong bảng tuần hoàn. A và B là kim loại hay phi kim?
Hướng dẫn giải:
Ta biết rằng: A và B nằm kế tiếp trong cùng một chu kỳ
⇒ ZB - ZA = 1 và ZA + ZB = 33
⇒ ZA = 16; ZB = 17. Vậy ZA = 16
⇒ Nguyên tố A nằm ở ô số 16
⇒ Nguyên tố A là lưu huỳnh
⇒ Nguyên tố A là phi kim. ZB = 17
⇒ Nguyên tố B nằm ở ô số 17
⇒ Nguyên tố B là clo
⇒ Nguyên tố B là phi kim
Bài tập 2: Nguyên tố X có đặc điểm như sau: điện tích hạt nhân là 11+, có 3 lớp electron, lớp ngoài cùng chứa 1 electron. Tính chất hóa học cơ bản của X là:
A. Tính kim loại mạnh.
B. Tính phi kim mạnh
C. X là khí hiếm
D. Tính kim loại yếu
Hướng dẫn giải:
- Nguyên tố X có số hiệu nguyên tử là 11
→ Nguyên tố X nằm ở ô số 11
→ Nguyên tố X là Na.
- Nguyên tố X có 3 lớp electron
→ Nguyên tố X thuộc chu kỳ 3
- Nguyên tố X có 1 electron ở lớp ngoài cùng
→ Nguyên tố X thuộc nhóm IA
→ Nguyên tố X nằm ở đầu chu kỳ
→ Nguyên tố X có tính kim loại mạnh
Đáp án A
Bài tập 3: Nguyên tố X có số hiệu nguyên tử 11, thuộc chu kỳ 3 và nhóm I trong bảng tuần hoàn. Phát biểu nào dưới đây là chính xác?
A. Điện tích hạt nhân 11+, có 3 lớp electron, lớp ngoài cùng chứa 1 electron, và tính kim loại mạnh.
B. Điện tích hạt nhân 11+, có 1 lớp electron, lớp ngoài cùng có 3 electron, và tính kim loại mạnh.
C. Điện tích hạt nhân 11+, có 3 lớp electron, lớp ngoài cùng chứa 3 electron, và tính kim loại yếu.
D. Điện tích hạt nhân 11+, có 3 lớp electron, lớp ngoài cùng chứa 1 electron, và tính kim loại yếu.
Lời giải: Đáp án A
Nguyên tố X có số hiệu nguyên tử là 11
→ Điện tích hạt nhân của X là 11+, và X thuộc chu kỳ 3
→ Nguyên tử X có 3 lớp electron
→ Nguyên tố X thuộc nhóm I
→ Nguyên tử X có 1 electron ở lớp ngoài cùng, có tính kim loại mạnh. Do đó, đáp án là C hoặc D.
Bài tập 4: Nguyên tử của nguyên tố X có 3 lớp electron, với 7 electron ở lớp ngoài cùng. Xác định vị trí và tính chất cơ bản của nguyên tố X là
A. Thuộc chu kỳ 3, nhóm VII và là kim loại mạnh
B. Thuộc chu kỳ 7, nhóm III và là kim loại yếu
C. Thuộc chu kỳ 3, nhóm VII và là phi kim mạnh
D. Thuộc chu kỳ 3, nhóm VII và là phi kim yếu
Hướng dẫn giải: Đáp án C
Nguyên tử của nguyên tố X có 3 lớp electron
→ Nguyên tố X thuộc chu kỳ 3, với 7 electron ở lớp ngoài cùng
→ Nguyên tố X thuộc nhóm VII, và vì thuộc nhóm VII nên X là phi kim mạnh.
3. Bài tập tự luyện
Bài 1: Nguyên tố X có số hiệu nguyên tử 11, nằm ở chu kỳ 3 và nhóm I trong bảng tuần hoàn. Phát biểu nào dưới đây là chính xác?
A. Điện tích hạt nhân 11+, có 3 lớp electron, lớp ngoài cùng chứa 1 electron, và tính kim loại mạnh.
B. Điện tích hạt nhân 11+, có 1 lớp electron, lớp ngoài cùng chứa 3 electron, và tính kim loại mạnh.
C. Điện tích hạt nhân 11+, có 3 lớp electron, lớp ngoài cùng có 3 electron, và tính kim loại yếu.
D. Điện tích hạt nhân 11+, có 3 lớp electron, lớp ngoài cùng chứa 1 electron, và tính kim loại yếu.
Bài 2: Nguyên tử của nguyên tố X có 3 lớp electron và lớp ngoài cùng chứa 7 electron. Xác định vị trí và tính chất cơ bản của nguyên tố X là:
A. Thuộc chu kỳ 3, nhóm VII A và là kim loại mạnh.
B. Thuộc chu kỳ 7, nhóm III A và là kim loại yếu.
C. Thuộc chu kỳ 3, nhóm VII A và là phi kim mạnh.
D. Thuộc chu kỳ 3, nhóm VII A và là phi kim yếu.
Bài 3: Trong chu kỳ 2, nguyên tố X là nguyên tố đầu tiên của chu kỳ, trong khi nguyên tố Y là nguyên tố đứng cuối chu kỳ nhưng trước khí hiếm. Tính chất của X và Y là:
A. X là kim loại mạnh, Y là phi kim yếu.
B. X là kim loại mạnh, Y là phi kim mạnh.
C. X là kim loại yếu, Y là phi kim mạnh.
D. X là kim loại yếu, Y là phi kim yếu.
Bài 4: Nguyên tử của nguyên tố X có tổng số hạt proton, nơtron và electron là 52. Trong hạt nhân của X, số hạt không mang điện vượt số hạt mang điện một đơn vị. Xác định vị trí của nguyên tố X trong bảng tuần hoàn:
A. Chu kỳ 3, nhóm VA.
B. Chu kỳ 3, nhóm VIIA.
C. Chu kỳ 2, nhóm VIIA.
D. Chu kỳ 2, nhóm VA.
Bài 5: Nguyên tố R thuộc nhóm VA trong bảng tuần hoàn. Hợp chất khí của nguyên tố này với hiđro có tỷ lệ khối lượng hiđro là 17,64%. Xác định công thức hợp chất khí với hiđro của nguyên tố R:
A. H2S. B. NH3. C. AsH3. D. PH3.
Bài 6: Nguyên tố X thuộc chu kỳ 3 nhóm VIA, còn nguyên tố Y thuộc chu kỳ 2 nhóm VIIA. So sánh tính chất của X và Y cho thấy:
A. Tính phi kim của X mạnh hơn Y.
B. Tính phi kim của Y mạnh hơn X.
C. Tính phi kim của X và Y tương đương nhau.
D. Tính kim loại của X và Y tương đương nhau.
Bài 7: Một oxit có tỷ khối hơi so với oxy là 2 và oxy chiếm 50% khối lượng. Xác định công thức của oxit này:
A. CO. B. CO2. C. SO2. D. NO2.
Bài 8: Kim loại A và B thuộc nhóm IIA, nằm ở hai chu kỳ liên tiếp. Một hỗn hợp 4,4 gam của A và B phản ứng với dung dịch HCl 1M dư, tạo ra 3,36 lít khí ở điều kiện tiêu chuẩn. Xác định hai kim loại A và B?
A. Mg và Ca. B. Ca và Ba. C. Be và Mg. D. Mg và Ba.
Bài 9: Nguyên tố Y, là một phi kim thuộc chu kỳ 3, nhóm VIA. Nguyên tố Y kết hợp với kim loại M tạo thành hợp chất MY, trong đó kim loại M chiếm 63,64% khối lượng. Xác định kim loại M là:
A. Zn. B. Cu. C. Mg. D. Fe.
