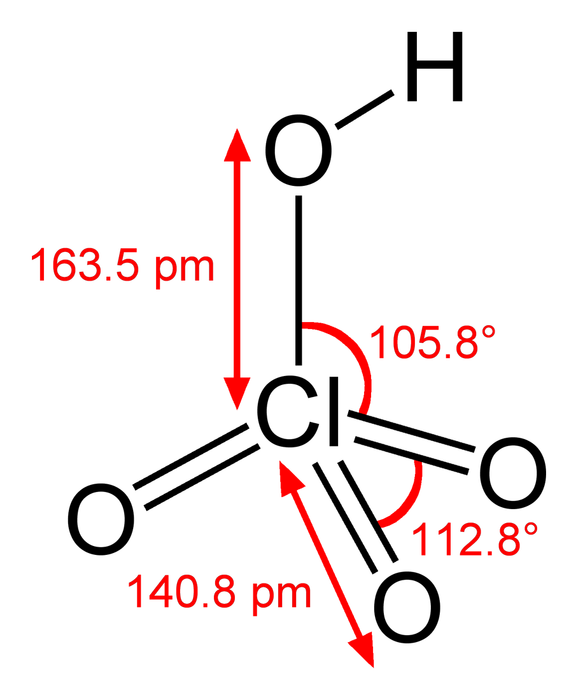
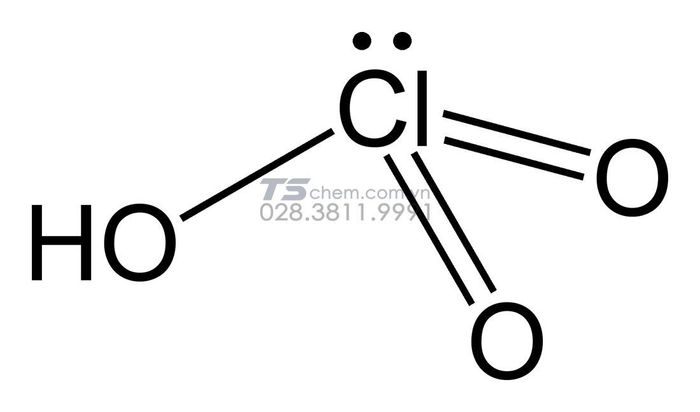
1. Axit Cloric – HClO3
- Công thức hóa học: HClO3
- Tính chất:
- Là hợp chất axit của Clo với tính axit mạnh mẽ.
- Axit cloric thường xuất hiện dưới dạng dung dịch trong suốt, không màu, dễ cháy và rất độc hại.
3. Ứng dụng:
- Được sử dụng để sản xuất các muối clorat như natri, canxi, magiê, strontium, chì, đồng và bạc clorat.
- Được dùng trong sản xuất vinyl clorua cho ống PVC.
- Còn là chất tiền ổn định cho clo dioxide và được sử dụng trong sản xuất ammonium perchlorate tinh khiết cao.
- Thường được dùng trong làm sạch và chất tẩy rửa.
2. Axit Hydroiodic - HI
- Công thức hóa học: HI
- Tính chất:
- Axit hydroiodic là một loại axit không oxy hóa mạnh, tương tự như axit hydrochloric và axit hydrobromic.
- Nó có mùi hăng, có khả năng ăn mòn kim loại và vải.
- Ở dạng khan (hydro iodua), nó là khí không màu, nhưng có thể chuyển sang màu vàng/nâu.
- HI không dễ cháy, nhưng tiếp xúc lâu với lửa hoặc nhiệt độ cao có thể gây nổ và vỡ thùng chứa.
- Axit hydroiodic và hydro iodua đều độc hại; hít phải, nuốt phải hoặc tiếp xúc với da có thể gây thương tích nghiêm trọng hoặc tử vong.
3. Ứng dụng:
- Được sử dụng để điều chế iodide.
- Thường dùng để phân tách ete để thu được iodua và rượu alkyl, cũng như làm chất khử.
- Ứng dụng trong tinh chế kim loại, hệ thống ống nước, tẩy trắng, khắc, mạ điện, chụp ảnh, khử trùng, đạn dược, sản xuất phân bón, làm sạch kim loại và loại bỏ rỉ sét.
- Trong sản xuất, HI còn được dùng làm chất tẩy rửa nhà vệ sinh, kim loại, thoát nước, tẩy rỉ sét, trong pin và làm sơn lót cho móng tay nhân tạo.
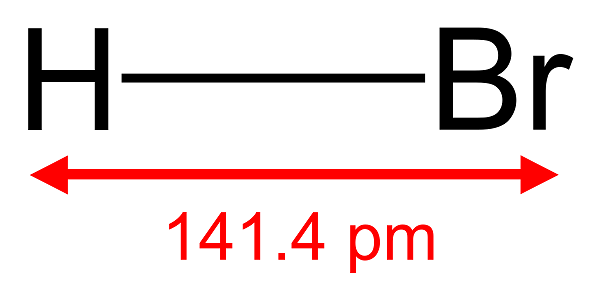
3. Axit Bromhidric – HBr
- Công thức hóa học: HBr
- Tính chất:
- Axit bromhidric là một axit mạnh, được tạo ra khi hòa tan khí bromua hydro trong nước.
- Nó mạnh hơn axit clohidric và là một trong những axit vô cơ mạnh nhất đã biết.
- HBr là chất lỏng không màu và dễ hòa tan trong nước.
3. Ứng dụng:
- Axit bromhidric chủ yếu được dùng để sản xuất các muối bromua như kẽm bromua, canxi bromua và natri bromua.
- Cũng được sử dụng trong tổng hợp các hợp chất brom hữu cơ, một số ete bị phân ly khi tiếp xúc với HBr.
- Đóng vai trò là chất xúc tác trong phản ứng ankyl hóa và trong quá trình tách chiết quặng.
- Những hợp chất brom hữu cơ quan trọng như anlyl bromua, axit bromaxetic và tetrabromobisphenol được chế tạo từ HBr.
4. Axit Clohidric – HCl
- Công thức hóa học: HCl
- Tính chất:
- Axit cloidhic, còn gọi là chloronium, được hình thành khi khí hydro clorua (HCl) hòa tan trong nước.
- Đây là dung dịch không màu và không mùi của hydro, clo và nước.
- Là một axit mạnh với khả năng ăn mòn cao.
- HCl là axit tự nhiên có mặt trong dịch vị dạ dày.
3. Ứng dụng:
- Được dùng trong sản xuất các hợp chất hữu cơ và vô cơ.
- Loại bỏ vết bẩn trên kim loại.
- Chất tẩy rửa hiệu quả cho hồ bơi.
- Làm sạch muối.
- Giúp trung hòa và kiểm soát độ pH.
- Tham gia vào quá trình tái tạo nhựa và trao đổi ion.
- Hỗ trợ tiêu hóa thức ăn trong dạ dày.
- Được sử dụng trong sản xuất dầu.

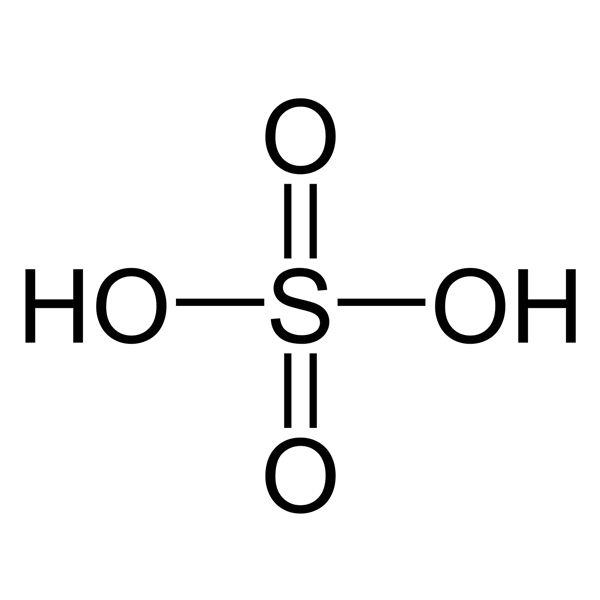
5. Axit Sunfuric – H2SO4
- Công thức hóa học: H2SO4
- Tính chất:
- Axit sunfuric là một axit rất mạnh, có khả năng ăn mòn nhiều loại kim loại như sắt và nhôm, ngay cả khi bị pha loãng. Dạng đậm đặc của nó rất nguy hiểm và có thể gây tổn thương nghiêm trọng.
- Ở dạng đặc, axit sunfuric là một chất lỏng nhờn, không màu.
- Axit này có thể hòa tan trong nước và giải phóng nhiệt trong quá trình hòa tan.
- Axit sunfuric có thể gây bỏng hóa học nặng nề, đồng thời phản ứng với nước sinh ra nhiệt cao gây bỏng nhiệt.
3. Ứng dụng:
- Được sử dụng trong pin chì và chất tẩy rửa cống.
- Tham gia vào sản xuất hóa chất, giấy bóng kính.
- Đóng vai trò quan trọng trong lọc dầu, chế tạo kim loại và xử lý nước.
- Ứng dụng trong ngành dược phẩm.
- Được sử dụng trong công nghiệp giấy, tách dầu cao và điều chỉnh độ pH.
- Tham gia vào sản xuất phân bón và thuốc diệt cỏ.
6. Axit Nitric – HNO3
- Công thức hóa học: HNO3
- Tính chất:
- Axit nitric, còn được biết đến với tên gọi aqua fortis hoặc axit azotic, là một axit khoáng mạnh với đặc tính oxy hóa rõ rệt.
- Ở dạng nguyên chất, axit này là một chất lỏng trong suốt không màu.
- Qua thời gian, axit nitric sẽ chuyển sang màu vàng do quá trình oxy hóa, và phân hủy thành nitơ oxit cùng nước.
4. Ứng dụng:
- Được dùng trong sản xuất chất nổ.
- Tham gia vào chế tạo mực, thuốc nhuộm và nhựa.
- Được sử dụng để sản xuất amoni nitrat cho phân bón.
- Được áp dụng trong các thí nghiệm hóa học tại phòng thí nghiệm.
- Hỗ trợ phân hủy các mẫu nước trong nghiên cứu.
- Đóng vai trò là chất oxy hóa trong tên lửa sử dụng nhiên liệu lỏng.
- Góp phần vào tổng hợp các hợp chất hữu cơ.
- Axit nitric với nồng độ thấp được dùng trong chế biến gỗ.

7. Axit Fluoroantimonic – H2FSbF6
- Công thức hóa học: H2FSbF6
- Tính chất:
- Axit fluoroantimonic phân hủy nhanh chóng và gây nổ khi tiếp xúc với nước, do đó không thể sử dụng trong môi trường chứa nước mà chỉ trong môi trường axit flohydric.
- Phát ra khí độc mạnh mẽ. Khi nhiệt độ tăng, axit này phân hủy và sinh ra khí hydro florua (axit flohydric).
- Axit fluoroantimonic mạnh gấp 20 nghìn tỷ lần so với axit sulfuric (H2SO4) đậm đặc 100%. Nó có giá trị H0 (hàm độ axit Hammett) cao nhất là -31,3.
- Có khả năng làm tan chảy thủy tinh và nhiều vật liệu khác, cũng như hầu hết các hợp chất hữu cơ (bao gồm cả cơ thể con người). Axit này được lưu trữ trong các lọ làm từ PTFE (polytetrafluoroethylene).
3. Ứng dụng:
- Axit fluoroantimonic được áp dụng trong kỹ thuật hóa học và hóa hữu cơ để phát triển các hợp chất hữu cơ mà không cần dung môi.
- Nó còn được dùng làm chất xúc tác trong các phản ứng alkyl hóa và acyl hóa trong ngành hóa dầu. Siêu axit này thường được sử dụng để tổng hợp và biểu thị đặc tính của carboncation.

8. Axit Carborane – H(CHB11Cl11)
- Công thức hóa học: H(CHB11Cl11)
- Tính chất:
- Axit carborane được coi là loại siêu axit mạnh nhất hiện nay, có độ pH lên tới -18.
- Loại axit này có tính ăn mòn rất thấp, có thể thao tác bằng tay mà không gặp vấn đề gì.
3. Ứng dụng:
- Teflon, lớp chống dính thường thấy trong các dụng cụ nấu ăn, có khả năng chứa carborane.
- Được dùng làm chất xúc tác trong quá trình crackinh hydrocacbon và phân hóa n- ankan để tạo ra các isoalkanes phân nhánh.
- Đóng vai trò là axit Brønsted mạnh, chọn lọc trong tổng hợp hóa học nhờ tính chất ưa nucleophin thấp.
- Trong hóa học hữu cơ, axit carborane được dùng để nghiên cứu các chất trung gian cation phản ứng.
- Trong tổng hợp vô cơ, tính axit vượt trội của chúng giúp phân lập các loài ngoại lai như muối của xenon proton.
9. Axit pecloric – HClO4
- Công thức hóa học: HClO4
- Tính chất:
- HClO4 là hợp chất vô cơ, thường ở dạng lỏng không màu và là một axit cực mạnh so với nitric và axit sulfuric.
- Không chỉ là axit mạnh, axit pecloric còn là chất oxi hóa mạnh mẽ, dễ hòa tan trong nước và tạo các hidrat với nước. Nó dễ bị phân hủy dưới áp suất thường và khi đun đến 100 độ C, sẽ chuyển thành dạng lỏng màu đỏ nâu và có nguy cơ gây nổ.
3. Ứng dụng:
- Axit pecloric được sản xuất hàng năm lên đến triệu tấn, chủ yếu để chế tạo amôni peclorat, dùng trong nhiên liệu tên lửa.
- Được ứng dụng trong việc chạm khắc lên bề mặt nhôm, môlybđen và một số kim loại khác.
- Được sử dụng như một dung môi hiệu quả trong sắc ký trao đổi ion.