

| Acetylen | |
|---|---|
Acetylen | |
Acetylen | |
Mô hình lấp đầy của phân tử acetylen | |
| Tên hệ thống | Ethyne |
| Nhận dạng | |
| Số CAS | 74-86-2 |
| PubChem | 6326 |
| KEGG | C01548 |
| ChEBI | 27518 |
| ChEMBL | 116336 |
| Số RTECS | AO9600000 |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ |
| InChI | đầy đủ |
| Tham chiếu Beilstein | 906677 |
| Tham chiếu Gmelin | 210 |
| UNII | OC7TV75O83 |
| Thuộc tính | |
| Bề ngoài | Khí không màu |
| Mùi | Không mùi |
| Khối lượng riêng | 1,1772 g/L = 1,1772 kg/m (0 °C, 101.3 kPa) |
| Điểm nóng chảy | Lỗi Lua trong Mô_đun:Convert tại dòng 328: attempt to compare number with nil. Điểm ba tại 1.27 atm |
| Điểm sôi | |
| Điều kiện thăng hoa | −84 °C; −119 °F; 189 K (1 atm) |
| Độ hòa tan trong nước | tan khá tốt |
| Độ hòa tan | tan khá tốt trong alcohol tan tốt trong acetone, benzen |
| Áp suất hơi | 44.2 atm (20 °C) |
| Độ axit (pKa) | 25 |
| MagSus | −20.8×10 cm/mol |
| Độ dẫn nhiệt | 21.4 mW·m·K (300 K) |
| Acid liên hợp | Ethynium |
| Cấu trúc | |
| Hình dạng phân tử | Tuyến tính |
| Nhiệt hóa học | |
| Entropy mol tiêu chuẩn S298 | 200.927 J·mol·K |
| Nhiệt dung | 44.036 J·mol·K |
| Các nguy hiểm | |
| NFPA 704 |
4
1
3
|
| Giới hạn nổ | 2.5–100% |
| PEL | none |
| REL | C 2500 ppm (2662 mg/m) |
| IDLH | N.D. |
| Ký hiệu GHS | |
| Báo hiệu GHS | Danger |
| Chỉ dẫn nguy hiểm GHS | H220, H336 |
| Chỉ dẫn phòng ngừa GHS | P202, P210, P233, P261, P271, P304, P312, P340, P377, P381, P403, P405, P501 |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa).
(cái gì ?)
Tham khảo hộp thông tin | |
Acetilen (tên gốc từ tiếng Pháp acétylène /asetilɛn/), tên hóa học là ethyn) là một hợp chất hóa học có công thức là C
2H
2 hay H−C≡C−H. Đây là hydrocarbon và là alkyn đơn giản nhất. Acetilen là một khí không màu, thường được sử dụng làm nhiên liệu và nguyên liệu để tổng hợp các hợp chất khác. Trong trạng thái nguyên chất, acetilen không ổn định, vì vậy thường được bảo quản trong dung dịch. Mặc dù khí acetilen nguyên chất không có mùi, nhưng trong các sản phẩm hóa chất thương mại, nó thường có mùi đặc trưng do sự hiện diện của các tạp chất như divinyl sulfide và phosphin.
Acetilen, với đặc điểm của một alkyn, là một hợp chất không bão hòa (không no) vì hai nguyên tử carbon liên kết với nhau bằng liên kết ba. Liên kết ba giữa các nguyên tử carbon khiến cho các nguyên tử trong phân tử sắp xếp thành một đường thẳng, với góc liên kết CCH là 180°.
Khám phá
Edmund Davy là người đầu tiên phát hiện acetilen vào năm 1836. Ông đã sử dụng acetilen trong 'bộ chế hòa khí hydro' của mình. Phát hiện này là một tình cờ khi ông cố gắng điều chế kim loại kali. Ông đã nung kali carbonat với carbon ở nhiệt độ cao, tạo ra sản phẩm phụ gọi là kali carbide (K2C2), và khi chất này phản ứng với nước, khí acetilen được giải phóng. Vào năm 1860, nhà hóa học người Pháp Marcellin Berthelot tiếp tục nghiên cứu và đặt tên khí này là acétylène. Công thức thực nghiệm của Berthelot cho acetilen là C4H2, với tên gọi 'quadricarbure d'hydrogène' (hydro quadricarbide). Công thức này không chính xác vì nhiều nhà hóa học thời đó đã sử dụng sai nguyên tử khối của carbon (6 thay vì 12). Berthelot đã điều chế khí này bằng cách cho hơi của các hợp chất hữu cơ (như methanol, ethanol, v.v.) đi qua ống nung nóng để thu được sản phẩm. Ông cũng phát hiện rằng acetilen có thể được tạo ra bằng cách phóng điện qua hỗn hợp khí cyanide và hydro. Acetilen còn được điều chế trực tiếp bằng cách cho hydro đi qua giữa các cực của hồ quang carbon.
Quy trình điều chế
Acetilen không có mặt tự nhiên trong môi trường.
Tại Trung Quốc, acetilen chủ yếu được sản xuất qua quá trình đốt cháy một phần khí tự nhiên.
Đốt cháy một phần hydrocarbon
Kể từ thập niên 1950, acetilen chủ yếu được tạo ra bằng cách đốt cháy một phần khí metan. C
2H
2 là sản phẩm phụ thu được trong quá trình sản xuất ethylen thông qua cracking hydrocarbon. Vào năm 1983, khoảng 400.000 tấn acetilen được sản xuất bằng phương pháp này. C
2H
2 trong ethylen là sản phẩm phụ không mong muốn do tính dễ cháy và khả năng làm hỏng chất xúc tác Ziegler–Natta. C
2H
2 thường được hydro hóa chọn lọc để chuyển thành ethylen, sử dụng chất xúc tác Pd–Ag.
Khi đốt cháy một phần khí metan, acetilen được tạo ra theo phản ứng hóa học sau:
3 CH
4 + 3 O
2 → C
2H
2 + CO + 5 H
2O
Khử hydro alkan
Các alkan nặng trong dầu mỏ và khí tự nhiên sẽ được 'bẻ gãy' thành các phân tử nhẹ hơn và khử hydro ở nhiệt độ cao:
C
2H
6 → C
2H
2 + 2 H
2
2 CH
4 → C
2H
2 + 2 CH
2
Quá trình phản ứng cuối cùng được thực hiện thông qua phân hủy khí metan bằng plasma vi sóng (microwave plasma). Công nghệ này có ưu điểm là không phát thải CO
2, và hydro là sản phẩm phụ.
Phương pháp hóa carbon
Trước những năm 1950, khi dầu thay thế than đá làm nguồn cung cấp carbon chủ yếu, acetylen và các hợp chất thơm trong nhựa than đá là nguồn cung cấp hóa chất hữu cơ chính trong ngành công nghiệp hóa chất. C
2H
2 được sản xuất bằng cách thủy phân canxi cacbua, phản ứng được Friedrich Wöhler phát hiện vào năm 1862 và vẫn được học sinh biết đến.
CaC
2 + 2 H
2O → Ca(OH)
2 + C
2H
2
Để sản xuất canxi cacbua, cần nhiệt độ rất cao, khoảng 2000 °C, trong lò hồ quang điện. Ở Mỹ, quy trình này đóng vai trò quan trọng trong cuộc cách mạng hóa học cuối thế kỷ 19 nhờ vào dự án thủy điện khổng lồ tại thác Niagara.
Liên kết
Theo lý thuyết liên kết hóa trị, trong mỗi nguyên tử carbon, orbital 2s kết hợp với một orbital 2p để tạo thành orbital lai hóa sp. Hai orbital 2p còn lại không tham gia lai hóa. Hai đầu của các orbital lai hóa sp chồng lên nhau tạo thành liên kết σ mạnh giữa các nguyên tử carbon, trong khi các nguyên tử hydro cũng liên kết bằng liên kết σ ở hai đầu còn lại. Hai orbital 2p tạo thành liên kết π yếu hơn.
Do acetylen có cấu trúc phân tử đối xứng tuyến tính, nên nhóm điểm của nó là D∞h.
Tính chất vật lý
Dạng vật chất
Ở điều kiện áp suất khí quyển, acetylen không thể tồn tại dưới dạng lỏng và không có điểm nóng chảy xác định. Điểm ba trên biểu đồ pha cho thấy điểm nóng chảy của acetylen là −80,8 °C tại áp suất tối thiểu 1,27 atm, nơi acetylen có thể ở dạng lỏng. Dưới nhiệt độ điểm ba, acetylen thể rắn có thể chuyển thẳng thành thể khí qua quá trình thăng hoa. Điểm thăng hoa ở áp suất khí quyển là −84,0 °C.
Các tính chất khác
Ở nhiệt độ phòng, acetylen hòa tan trong aceton với độ hòa tan 27,9 g/kg. Khi hòa tan C
2H
2 cùng dimethylformamide (DMF), độ hòa tan là 51 g. Ở áp suất 20,26 bar, độ hòa tan trong aceton và DMF lần lượt là 689,0 và 628,0 g. Những dung môi này được sử dụng trong các bình chứa khí áp suất.
Các ứng dụng
Hàn xì
Ngành công nghiệp khí công nghiệp cung cấp khoảng 20% acetylen để sử dụng trong hàn và cắt dưới dạng oxyacetylen. Khi acetylen cháy cùng oxy, nó tạo ra một ngọn lửa có nhiệt độ lên tới hơn 3.600 K (3.330 °C; 6.020 °F), giải phóng năng lượng 11,8 kJ/g. Oxyacetylene là loại khí đốt có nhiệt độ nóng nhất. Acetylene đứng thứ ba về nhiệt độ nóng trong các ngọn lửa hóa học tự nhiên, sau dicyanoacetylen với nhiệt độ lên đến 5.260 K (4.990 °C; 9.010 °F) và cyanogen với nhiệt độ đạt 4.798 K (4.525 °C; 8.177 °F). Hàn oxy-acetylen từng là một phương pháp phổ biến trong quá khứ, nhưng sự phát triển của công nghệ hàn hồ quang đã làm giảm sự sử dụng của nó. Tuy nhiên, thiết bị hàn oxy-acetylen vẫn rất linh hoạt, đặc biệt trong các ứng dụng như hàn sắt thép, đồng, đồng thau, gia nhiệt kim loại, hoặc nới lỏng các đai ốc và bu lông bị ăn mòn. Phương pháp này vẫn được sử dụng ở những nơi không có điện. Để sử dụng an toàn trong hàn và cắt, áp suất acetylen cần được kiểm soát bằng bộ điều chỉnh, vì ở áp suất trên 15 psi (100 kPa), acetylen có thể phân hủy nhanh chóng thành hydro và carbon nếu gặp sóng xung kích như cháy ngược.

Hóa chất
Một trong những ứng dụng hóa học quan trọng của acetylen là ethynyl hóa formaldehyde. Khi acetylen phản ứng với aldehyde và keton, nó tạo ra các rượu α-ethynyl.
Phản ứng tạo butynediol với sản phẩm phụ là rượu propargyl, sử dụng chất xúc tác đồng(I) acetylide.
Ngoài việc ethynyl hóa, acetylen còn phản ứng với carbon monoxide để tạo ra acid acrylic hoặc các ester acrylic, quá trình này cần xúc tác kim loại. Các sản phẩm từ phản ứng này bao gồm sợi acrylic, thủy tinh, sơn, nhựa, và polyme. Trừ Trung Quốc, việc sử dụng acetylen làm nguyên liệu hóa học đã giảm 70% từ năm 1965 đến năm 2007 vì lý do chi phí và môi trường.
Ứng dụng
Vào năm 1881, nhà hóa học Nga Mikhail Kucherov đã mô tả quá trình hydrat hóa acetylen để tạo ra acetaldehyde bằng cách sử dụng các chất xúc tác như thủy ngân(II) bromide. Trước khi quy trình Wacker ra đời, phản ứng này đã được thực hiện ở quy mô công nghiệp.
Phản ứng trùng hợp acetylen dưới tác dụng của xúc tác Ziegler–Natta dẫn đến sự hình thành polyacetylen. Polyacetylene là chuỗi liên kết gồm các trung tâm CH với liên kết đơn và đôi xen kẽ, và là một trong những chất bán dẫn hữu cơ đầu tiên được phát hiện. Khi polymer phản ứng với iod, vật liệu dẫn điện cao được tạo ra. Mặc dù vật liệu này không có nhiều ứng dụng thực tế, nhưng nó đã mở đường cho sự phát triển của chất bán dẫn hữu cơ. Giải Nobel Hóa học năm 2000 được trao cho Alan J. Heeger, Alan G. MacDiarmid và Hideki Shirakawa vì những nghiên cứu này.
Trong những năm 1920, acetylen tinh khiết đã được thử nghiệm như một loại thuốc gây mê dạng hít.
Acetylene thỉnh thoảng được sử dụng để thấm carbon, tức là làm cứng thép, trong các lò nung với khối lượng thép lớn.
Acetylene cũng được áp dụng để bay hơi carbon trong phương pháp xác định niên đại bằng carbon phóng xạ. Vật liệu carbon trong mẫu khảo cổ được xử lý với kim loại lithi trong lò nghiên cứu chuyên dụng nhỏ, tạo thành lithi carbide (hay còn gọi là lithi acetylide). Carbide này sau đó phản ứng với nước để tạo ra khí acetylen, và khí này được đưa vào máy quang phổ khối để đo tỷ lệ đồng vị carbon-14 và carbon-12.
Khi đốt cháy acetylen, nó phát ra ánh sáng rất mạnh. Sự phổ biến của đèn caride đã thúc đẩy việc thương mại hóa acetylen vào đầu thế kỷ 20. Vào thời điểm đó, acetylen được sử dụng trong các ngọn hải đăng ven biển, đèn đường, đèn pha ô tô và đèn khai thác mỏ gắn trên mũ bảo hộ. Tuy nhiên, việc đốt acetylen trực tiếp có nguy cơ cháy nổ cao, vì vậy nó đã được thay thế bằng đèn sợi đốt, sau đó là đèn LED với hiệu suất cao hơn. Dù vậy, đèn acetylen vẫn được sử dụng trong các khu vực xa xôi hoặc nơi có hệ thống điện lưới còn hạn chế.
Xuất hiện trong tự nhiên
Liên kết ba C≡C của acetylen, với mức năng lượng cao và khả năng hòa tan tốt trong nước, làm cho nó trở thành nguồn thức ăn lý tưởng cho một số loại vi khuẩn. Một số vi khuẩn đã được phát hiện có thể sống nhờ acetylen. Enzyme acetylene hydratase xúc tác quá trình chuyển hóa acetylen thành acetaldehyde:
- C
2H
2 + H
2O → CH
3CHO
Acetylene là một hợp chất phổ biến trong vũ trụ, đặc biệt liên quan đến khí quyển của các hành tinh khí khổng lồ. Acetylen đã được phát hiện trên Enceladus, một vệ tinh của Sao Thổ. Acetylene tự nhiên được cho là hình thành từ sự phân hủy xúc tác các hydrocarbon chuỗi dài ở nhiệt độ từ 1.700 K (1.430 °C; 2.600 °F) trở lên. Phát hiện này có thể gợi ý về các phản ứng xúc tác xảy ra trong vệ tinh này, làm cho nó trở thành địa điểm tiềm năng để tìm kiếm hóa học tiền sinh học.
Phản ứng
Phản ứng vinyl hóa
Trong các phản ứng vinyl hóa, các hợp chất H−X tham gia phản ứng cộng với liên kết ba của acetylen. Cả alcohol và phenol khi phản ứng với acetylen sẽ tạo ra vinyl ether, còn thiol thì tạo thành vinyl thioether. Vinylpyrrolidone và vinylcarbazole được sản xuất công nghiệp thông qua phản ứng vinyl hóa 2-pyrrolidone và carbazole.
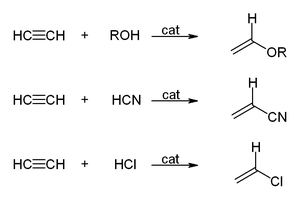
Quá trình hydrat hóa acetylen, mặc dù là một dạng phản ứng vinyl hóa, nhưng vinyl alcohol sinh ra sẽ chuyển hóa thành acetaldehyde qua quá trình đồng phân hóa. Phản ứng này được xúc tác bởi muối thủy ngân. Dù từng là phương pháp chính để sản xuất acetaldehyde, công nghệ này đã bị quy trình Wacker thay thế. Quy trình Wacker sử dụng oxy hóa ethylen, một nguyên liệu rẻ hơn. Tương tự, quá trình hydrochlor hóa để chuyển đổi acetylen thành vinyl chloride cũng đã được thay thế bằng quá trình oxychlor hóa ethylene.
Vinyl acetat thường được sử dụng thay cho acetylen trong một số phản ứng vinyl hóa, đặc biệt là trong phản ứng transvinyl hóa. Các ester của vinyl acetat cũng đã được ứng dụng để tổng hợp vinyl format.
Hóa học cơ-kim
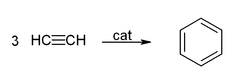
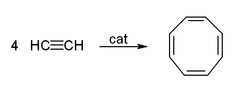
Acetylene và các dẫn xuất của nó (như 2-butyn, diphenylacetylen, v.v.) có khả năng hình thành các phức chất với các kim loại chuyển tiếp, được gọi là phức alkyn kim loại chuyển tiếp. Liên kết của acetylen với kim loại tương tự như liên kết trong các phức ethylen. Những phức chất này là các chất trung gian quan trọng trong nhiều phản ứng xúc tác, chẳng hạn như trimer hóa alkyn thành benzen, tetramer hóa thành cyclooctatetraen, và carbonyl hóa thành hydroquinone.
- Phản ứng giữa Fe(CO)₅ với 4 C₂H₂ và 2 H₂O dưới điều kiện 50–80°C và 20–25 atm tạo ra 2 C₆H₄(OH)₂ và FeCO₃.
Acetylide kim loại có cấu trúc dạng LₙM−C₂R, ví dụ như đồng(I) acetylide và bạc acetylide.
Phản ứng acid-base
Acetylene có pKₐ là 25, và khi bị deproton hóa bởi một siêu base, nó tạo thành acetylide.
- HC≡CH + RM → RH + HC≡CM
Nhiều loại hợp chất hóa học cơ kim và vô cơ đều sở hữu tính chất này.
Hydro hóa
Acetylene có thể được chuyển hóa một phần thành ethylene, cung cấp nguyên liệu cho nhiều loại nhựa polyethylen. Các halogen có thể phản ứng cộng vào liên kết ba của acetylene.
An toàn và xử lý
Acetylene không gây độc, nhưng khi được sản xuất từ calci carbide, có thể chứa một số tạp chất độc hại như phosphine và arsine, khiến khí có mùi giống tỏi. Acetylene rất dễ cháy, như hầu hết các hydrocarbon nhẹ, nên được dùng trong hàn. Các bộ điều chỉnh và đồng hồ đo áp suất thường ghi rõ áp suất an toàn cho acetylene là 101 kPa (gage), tương đương 15 psig. Do đó, acetylene nên được lưu trữ hòa tan trong aceton hoặc dimethylformamide (DMF) và chứa trong bình có lớp làm đầy xốp (Agamassan) để đảm bảo an toàn. Bình chứa acetylene nên được đặt thẳng đứng để tránh việc hút phải aceton khi sử dụng.
Đồng không thể được sử dụng để vận chuyển acetylene vì nó xúc tác quá trình phân hủy của acetylene.
Bình chứa khí cần được lưu trữ ở khu vực tách biệt với các chất oxy hóa để ngăn ngừa phản ứng nghiêm trọng trong trường hợp xảy ra cháy hoặc rò rỉ. Tránh đặt bình chứa acetylene ở những không gian kín hẹp, trong gara hoặc các tòa nhà để giảm nguy cơ cháy nổ nếu xảy ra rò rỉ ngoài ý muốn.
