
| Acid hydrochloric | |||
|---|---|---|---|
|
| |||
|
| |||
| Danh pháp IUPAC | Chlorane | ||
| Tên khác | Acid muriatic, acid chlorhidric, oxonium chloride | ||
| Nhận dạng | |||
| Số CAS | 7647-01-0 | ||
| PubChem | 313 | ||
| Số EINECS | 231-595-7 | ||
| Số RTECS | MW4025000 | ||
| Thuộc tính | |||
| Công thức phân tử | HCl | ||
| Khối lượng mol | 36,46 g/mol | ||
| Bề ngoài | Chất lỏng, trong suốt | ||
| Khối lượng riêng | 1,18 g/cm³ (đa giá trị, đây là tỷ trọng của dung dịch 36-38%) | ||
| Điểm nóng chảy | –27,32 °C (247 K) Dung dịch 38%. | ||
| Điểm sôi | 110 °C (383 K), dung dịch 20,2%; 48 °C (321 K), dung dịch 38%. | ||
| Độ hòa tan trong nước | Tan giới hạn | ||
| Độ hòa tan | Tan trong đimêtyl ête, Etanol, Methanol | ||
| Độ axit (pKa) | –8,0 | ||
| Chiết suất (nD) | 1,342 | ||
| Độ nhớt | 1,9·10 Pa·s ở 25 °C, dung dịch 31,5% | ||
| Các nguy hiểm | |||
| MSDS | MSDS:: Hydrochloric Acid 37% | ||
| Phân loại của EU | Độc hại (T) Gây ăn mòn mạnh (C) Gây nguy hiểm cho môi trường (N) | ||
| Chỉ mục EU | 017-002-01-X | ||
| NFPA 704 |
0
3
1
COR
| ||
| Chỉ dẫn R | R34, R37 | ||
| Chỉ dẫn S | (S1/2), S26, S45 | ||
| Điểm bắt lửa | Không cháy | ||
| Các hợp chất liên quan | |||
| Acid hydrohalogenic liên quan | Acid hydrobromic Acid hydrofluoric Acid hydroiodic | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa).
(cái gì ?)
Tham khảo hộp thông tin | |||
Acid clohidric (tiếng Anh: Hydrochloric acid), còn được gọi là acid muriatic, là một loại axit vô cơ mạnh, được tạo thành từ sự tan chảy của khí clo hydro (công thức hóa học: HCl) trong nước. Ban đầu, axit này được sản xuất từ axit sulfuric và muối ăn từ thời Phục Hưng, thậm chí từ thời Trung Cổ, và sau đó được các nhà hóa học Glauber, Priestley và Davy sử dụng trong các nghiên cứu khoa học của họ. Axit clohidric có thể được tìm thấy trong dịch vị và là một trong những yếu tố gây loét dạ dày khi hệ thống tự bảo vệ của dạ dày hoạt động không hiệu quả.
Axit clohidric đậm đặc có nồng độ tối đa là 40%. Ở dạng đậm đặc, axit này có thể tạo thành các sương mù axit, có khả năng ăn mòn các mô con người, gây tổn thương cho hệ thống hô hấp, mắt, da và ruột. Ở dạng loãng, axit clohidric được sử dụng làm chất vệ sinh, lau chùi nhà cửa, sản xuất gelatin và các phụ gia thực phẩm, tẩy rửa và xử lý da. Axit clohidric dạng hỗn hợp đẳng phí (gần 20,2%) có thể được sử dụng như một tiêu chuẩn cơ bản trong phân tích định lượng.
Axit clohidric được sản xuất quy mô lớn và là một phần của cách mạng công nghiệp vào thế kỷ XVIII, chủ yếu được sử dụng trong ngành công nghiệp hóa chất để sản xuất nhựa PVC và các sản phẩm trung gian như MDI/TDI để tạo ra polyurethane. Khoảng 20 triệu tấn axit clohidric được sản xuất hàng năm.
Nguyên liệu
Axit clohidric được các nhà giả kim châu Âu gọi là dung dịch muối (spirits of salt) hay acidum salis (acid muối). Cả hai tên vẫn còn được sử dụng, đặc biệt là trong các ngôn ngữ ngoài tiếng Anh như tiếng Đức: Salzsäure và tiếng Hà Lan: Zoutzuur. Khí HCl được gọi là khí acid biển (marine acid air). Tên cũ là acid muriatic (muriatic acid) có cùng nguồn gốc (muriatic nghĩa là 'liên quan đến nước muối hay muối'), và tên gọi này thỉnh thoảng vẫn được sử dụng.
Lịch sử

Không có nhiều tài liệu rõ ràng cho thấy axit clohidric được điều chế vào thời kỳ Trung cổ. Có vẻ như nguồn đầu tiên đề cập đến việc điều chế vào thế kỷ XV và XVI, nhưng vẫn còn là vấn đề tranh cãi. Một số tác giả vẫn giữ quan điểm rằng axit này được Basil Valentine, thầy tu dòng Benedict Đức, phát hiện vào thế kỷ XV, bằng cách nung muối ăn (NaCl) và axit sulfuric (H
2SO
4) lục. Nước cường toan, một hỗn hợp giữa axit nitric và axit clohidric đã được mô tả bởi nhà giả kim châu Âu thế kỷ XIII PseudoGeber (Paul of Taranto).
Vào thế kỷ XVII, Johann Rudolf Glauber ở Karlstadt am Main, Đức, đã sử dụng muối ăn và axit sulfuric để điều chế natri sulfat Na2SO4 bằng phản ứng Mannheim giải phóng khí hydro chloride. Joseph Priestley ở Leeds, Anh đã tạo ra hydro chlorua tinh khiết năm 1772, vào năm 1818 Humphry Davy ở Penzance, Anh đã chứng minh rằng thành phần hóa học bao gồm hydro và clo. Phản ứng Mannheim được mô tả như sau:
2 NaCl + H2SO4 → Na2SO4 + 2 HCl
Trong giai đoạn cách mạng công nghiệp tại châu Âu, nhu cầu về kiềm tăng cao, Nicolas Leblanc (tại Issoundun, Pháp) đã đề xuất phương pháp sản xuất natri cacbonat (Na2CO3 - tro soda) có chi phí thấp và số lượng lớn. Theo công nghệ Leblanc, muối ăn được chuyển hóa thành tro soda thông qua axit sulfuric và than, đồng thời tạo ra hydro clorua. Trước khi Đạo luật Alkali 1863 được ban hành tại Anh và các nước khác, lượng HCl dư thải ra môi trường không khí. Sau khi luật này có hiệu lực, các nhà sản xuất tro soda đã sử dụng nước để hấp thụ khí này, đồng thời sản xuất axit hydro clorua trên quy mô công nghiệp.
Trong thế kỷ XX, công nghệ Leblanc đã bị thay thế hoàn toàn bởi công nghệ Solvay mà không sinh ra sản phẩm axit hydro clorua. Vì axit hydro clorua được sử dụng rộng rãi trong nhiều lĩnh vực, nên nhu cầu thương mại đã đòi hỏi phải có các phương pháp sản xuất khác, một số trong số đó vẫn còn được sử dụng cho đến ngày nay. Sau năm 2000, axit hydro clorua chủ yếu được sản xuất bằng cách hấp thụ khí hydro clorua từ quá trình sản xuất các hợp chất hữu cơ công nghiệp.
Từ năm 1988, axit hydro clorua đã được xếp vào bảng II của Công ước Liên Hợp Quốc về Chống vận chuyển trái phép ma túy và các chất hướng thần năm 1998 (Bảng II là các chất tiền chế theo Công ước Liên Hợp Quốc năm 1988 về Chống vận chuyển trái phép ma túy và các chất hướng thần) do nó được sử dụng trong quá trình điều chế heroin, cocaine và methamphetamine.
Đặc tính của axit hydro clorua
Tính chất hóa học

Axit hydro clorua là một loại axit đơn proton, có khả năng phân ly thành ion H và ion Cl. Khi tan trong nước, H tạo liên kết với phân tử nước tạo thành ion hydronium, H3O+.
Vì phân ly hoàn toàn trong nước, acid hydrocloric được xem là một trong những acid mạnh. Các acid monoproton có hằng số điện li, Ka, thể hiện mức độ phân ly của chúng trong nước. Đối với các acid mạnh như HCl, Ka có giá trị lớn, và đã có nhiều nghiên cứu lý thuyết để xác định giá trị Ka của HCl. Giá trị pKa thường được tính từ Ka, với giá trị dao động từ -3 đến -7, thậm chí có thể đến -9,3.
Khi cho các muối clorua như NaCl vào dung dịch HCl, chúng không ảnh hưởng đến giá trị pH, điều này cho thấy rằng ion Cl là một gốc base yếu và HCl phân ly hoàn toàn trong dung dịch. Đối với các dung dịch acid hydrocloric từ trung bình đến mạnh, số mol H bằng với số mol HCl với độ tin cậy đến 4 chữ số thập phân.
Trong số sáu acid vô cơ mạnh phổ biến, acid hydrocloric là một acid monoproton ít có khả năng tham gia vào các phản ứng oxy hóa khử. Nó là một trong những loại acid mạnh ít độc hại khi tiếp xúc với da; ngoài tính acid, nó cũng bao gồm các ion clorua không độc hại và không phản ứng. Các dung dịch acid hydrocloric từ trung bình đến mạnh thường ổn định khi lưu trữ.
Acid hydrocloric thường được sử dụng rộng rãi trong chuẩn độ dung dịch base. Các acid chuẩn độ mạnh thường cho kết quả chính xác hơn do có điểm tương đối rõ ràng. Acid hydrocloric dạng hỗn hợp đẳng phân (gần 20,2%) có thể được sử dụng như một tiêu chuẩn cơ bản trong phân tích lượng, mặc dù nồng độ chính xác của nó phụ thuộc vào áp suất khí quyển trong quá trình điều chế.
Acid hydrocloric thường được sử dụng trong việc chuẩn bị mẫu trong hóa phân tích. Acid hydrocloric đặc có thể tan chảy một số kim loại, tạo thành khí hydro và clorua. Nó phản ứng với các hợp chất base như canxi cacbonat hoặc oxit đồng(II), tạo thành các dung dịch tan có thể được sử dụng cho phân tích.
Tương tự như các loại acid khác, HCl có thể phản ứng với:
- Kim loại: Giải phóng khí hydro và tạo muối clorua (ngoại trừ các kim loại đứng sau hydro trong dãy hoạt động hóa học như Cu, Hg, Ag, Pt, Au).
- Fe + 2HCl → FeCl2+ H2
- Oxide base: Tạo muối clorua và nước.
- ZnO + 2HCl → ZnCl2 + H2O
- Base: Tạo muối clorua và nước.
- NaOH + HCl → NaCl + H2O
- Muối: tác dụng với các muối có gốc anion yếu hơn tạo ra muối mới và axit mới.
- CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Hơn nữa, trong một số trường hợp, axit hydrocloric cũng có thể thể hiện tính khử bằng cách khử một số hợp chất như KMnO4 (đặc), MnO2, KClO3 giải phóng khí clo.
- 2KMnO4(đặc) + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8 H2O
- MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Đặc điểm vật lý
Ở điều kiện bình thường (nhiệt độ và áp suất chuẩn, ánh sáng chiếu sáng), dung dịch axit hydrocloric thường thấy là một chất lỏng trong suốt hoặc màu vàng nhạt (do sự hiện diện của các hợp chất), có thể tỏa khói, có tính nhớt, nặng hơn nước, khúc xạ ánh sáng nhiều hơn nước một chút:
| Nồng độ | Mật độ | Nồng độ mol |
pH | Độ nhớt | Nhiệt dung riêng |
Áp suất hơi | Điểm sôi | Điểm nóng chảy | ||
|---|---|---|---|---|---|---|---|---|---|---|
| kg HCl/kg | kg HCl/m³ | Baumé | kg/l | mol/dm³ | mPa•s | kJ/(kg•K) | Pa | °C | °C | |
| 10% | 104,80 | 6,6 | 1,048 | 2,87 | −0,5 | 1,16 | 3,47 | 0,527 | 103 | −18 |
| 20% | 219,60 | 13 | 1,098 | 6,02 | −0,8 | 1,37 | 2,99 | 27,3 | 108 | −59 |
| 30% | 344,70 | 19 | 1,149 | 9,45 | −1,0 | 1,70 | 2,60 | 1.410 | 90 | −52 |
| 32% | 370,88 | 20 | 1,159 | 10,17 | −1,0 | 1,80 | 2,55 | 3.130 | 84 | −43 |
| 34% | 397,46 | 21 | 1,169 | 10,90 | −1,0 | 1,90 | 2,50 | 6.733 | 71 | −36 |
| 36% | 424,44 | 22 | 1,179 | 11,64 | −1,1 | 1,99 | 2,46 | 14.100 | 61 | −30 |
| 38% | 451,82 | 23 | 1,189 | 12,39 | −1,1 | 2,10 | 2,43 | 28.000 | 48 | −26 |
| Bảng trên sử dụng nhiệt độ 20 °C và áp suất 1 atm (101,325 kPa). | ||||||||||
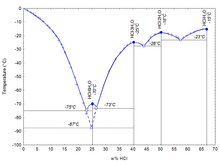
Các đặc tính vật lý của axit hydrocloric như điểm sôi và điểm nóng chảy, mật độ, và pH phụ thuộc vào nồng độ mol của HCl trong dung dịch axit. Chúng thay đổi trong dung dịch với nồng độ phần trăm rất thấp từ 0% HCl đến hơn 40% HCl.
Axit hydrocloric ở dạng hỗn hợp hai thành phần gồm HCl và H2O có điểm sôi hỗn hợp đẳng phí khi nồng độ 20,2% HCl và nhiệt độ 108,6 °C (227 °F). Có bốn điểm eutectic cố định cho HCl, giữa các dạng tinh thể của HCl•H2O (68% HCl), HCl•2H2O (51% HCl), HCl•3H2O (41% HCl), HCl•6H2O (25% HCl), và đóng băng (0% HCl). Cũng có điểm eutectic ổn định ở nồng độ 24,8% giữa dạng băng và HCl•3H2O tinh thể.
Sản xuất và chế biến
Axit hydrocloric được sản xuất với nồng độ lên đến 38% HCl (nồng độ phần trăm). Các mức nồng độ cao hơn khoảng 40% có thể được sản xuất hóa học nhưng tốc độ bay hơi cao yêu cầu điều kiện cất giữ và sử dụng đặc biệt, đặc biệt là trong môi trường áp suất và nhiệt độ thấp. Axit hydrocloric thường được sử dụng trong công nghiệp với nồng độ từ 30% đến 34%, nhằm giảm thiểu thất thoát khí HCl bay hơi trong quá trình vận chuyển. Dung dịch được sử dụng cho mục đích gia đình ở Hoa Kỳ thường có nồng độ từ 10% đến 12%, với khuyến cáo pha loãng trước khi sử dụng. Ở Anh, chất này được bán dưới tên gọi 'Spirits of Salt' để sử dụng làm vệ sinh trong nhà, có độ acid tương tự như các sản phẩm công nghiệp ở Mỹ.
Hầu hết axit hydrocloric được sản xuất ở Mỹ, Tây Âu và Nhật Bản dưới dạng sản phẩm phụ từ phương pháp chlor hóa hợp chất hữu cơ. Các nhà sản xuất hàng đầu bao gồm Dow Chemical, FMC, Georgia Gulf, Tập đoàn Tosoh, Akzo Nobel, và Tessenderlo. Dow Chemical mỗi năm sản xuất 2 triệu tấn theo khí HCl; các công ty khác sản xuất từ 0,5 đến 1,5 triệu tấn/năm. Tổng sản lượng trên toàn cầu, tính bằng HCl, ước tính là 20 triệu tấn/năm, trong đó 3 triệu tấn/năm từ quá trình tổng hợp trực tiếp, phần còn lại là sản phẩm phụ từ các quy trình tổng hợp hữu cơ và tương tự. Hiện nay, hầu hết axit hydrocloric được tiêu thụ chủ yếu bởi các nhà sản xuất làm nguyên liệu, phụ liệu để sản xuất các sản phẩm khác. Thị trường tiêu thụ toàn cầu khoảng 5 triệu tấn/năm.
Axit hydrocloric được sản xuất/điều chế theo các quy trình sau:
Tổng hợp từ các nguyên tố
Quá trình này tổng hợp trực tiếp từ khí clo và hydro để tạo ra sản phẩm có độ tinh khiết cao.
- H2 + Cl2 → 2 HCl
- (ΔH= -184,74 KJ/mol)
Phản ứng diễn ra trong buồng đốt với sự cung cấp khí clo và hydro ở nhiệt độ trên 2000 °C và hiện diện ngọn lửa. Để đảm bảo phản ứng diễn ra hoàn toàn, lượng hydro được cung cấp nhiều hơn một chút so với khí clo (1-2%) để không còn clo dư trong sản phẩm. Hỗn hợp của hydro và clo có khả năng gây nổ, do đó cần thiết kế các thiết bị đặc biệt chịu được nhiệt độ cao, tuy nhiên chi phí cho các chất phản ứng lại khá cao.
Phản ứng với clorua kim loại
Phản ứng với clorua kim loại, đặc biệt là natri clorua (NaCl), với axit sulfuric H2SO4 hoặc hidro sunfat: Quá trình này thường được áp dụng trong thế kỷ XVIII và được biết đến với tên gọi quy trình Leblanc trong sản xuất natri cacbonat. Phản ứng bao gồm 2 giai đoạn: giai đoạn 1 diễn ra ở nhiệt độ khoảng 150-250°C, và giai đoạn 2 diễn ra ở nhiệt độ khoảng 500 đến 600°C:
- NaCl + H2SO4 đặc → NaHSO4 + HCl↑
- NaCl + NaHSO4 → Na2SO4 + HCl↑
Phản ứng tổng có thể được viết như sau:
- 2 NaCl + H2SO4 → Na2SO4 + 2HCl↑
Chiều cân bằng của phản ứng diễn ra về phía tạo ra khí HCl vì khí này được loại bỏ liên tục. Phương pháp này cho phép sản xuất các sản phẩm tinh khiết, thường được áp dụng trong phòng thí nghiệm. Tuy nhiên, không phổ biến trong sản xuất thương mại do acid sulfuric có giá thành cao hơn acid hydrochloric.
Sản phẩm chlor hóa trong sản xuất hóa chất hữu cơ
Các phản ứng chính:
- Nhiệt phân 1,2-dichloroethan tạo thành vinyl chloride, 90% acid hydrochloric sử dụng trong sản xuất ở Mỹ được thực hiện bằng phương pháp chlor hóa này:
- C
2H
4+ Cl
2 → C
2H
4Cl
2 - C
2H
4Cl
2 → C
2H
3Cl + HCl
- Chlor hóa các hydrocarbon:
- Cl2 + RH → RCl + HCl
- với R là các gốc hydrocarbon.
- Phản ứng trao đổi gốc chlor với HF. Phản ứng này được sử dụng để chuyển đổi sản phẩm chlor hóa (RCl) thành HCl.
- RCl + HF → RF + HCl
- Tổng hợp tetrafluoroeten từ việc nhiệt phân chlorodifluorometan:
- 2 CHF2Cl → CF2=CF2 + 2 HCl
- Từ việc đốt cháy chất thải hữu cơ chlor:
- C
4H
6Cl
2 + 5O
2 → 4CO
2 + 2H
2O + 2HCl
Hydrat hóa clorua kim loại nặng
- 2FeCl3 + 6H2O → Fe2O3 + 3H2O + 6HCl
Sau khi tạo ra khí HCl, dòng khí chứa HCl được dẫn qua tháp hấp thụ, nơi mà HCl lỏng đậm đặc được hình thành bằng cách hấp thụ hơi HCl vào dung dịch acid hydrocloric yếu và được tách ra. Dòng khí cuối cùng được đưa qua thiết bị làm sạch để loại bỏ HCl tự do trước khi xả ra môi trường.
Ứng dụng

Axit hydrocloric là một axit mạnh được áp dụng trong nhiều ngành công nghiệp. Ứng dụng chủ yếu là để đánh giá chất lượng sản phẩm theo yêu cầu.
Tẩy rỉ thép
Một trong những ứng dụng quan trọng của axit hydrocloric là loại bỏ rỉ sắt trên thép, đó là các oxit sắt, trước khi thép được sử dụng cho các mục đích khác như cán, mạ điện và các kỹ thuật khác. Axit HCl với nồng độ 18% là phổ biến trong kỹ thuật làm sạch rỉ sắt trên các loại thép carbon.
- Fe2O3 + 6 HCl → 2 FeCl3 + 3 H2O
Sắt(II) chloride tái sử dụng nhiều lần trong công nghiệp được gọi là dung dịch acid, tuy nhiên hàm lượng kim loại nặng cao có thể làm giảm hiệu quả của phản ứng.
Công nghệ tái chế acid hydrochloric trong sản xuất thép đã phát triển, ví dụ như công nghệ lò phun hoặc tái sinh HCl từ chất lỏng tẩy rửa. Công nghệ tái chế phổ biến nhất là pyrohydrolysis, phản ứng được thực hiện như sau:
- 4 FeCl2 + 4 H2O + O2 → 8 HCl+ 2 Fe2O3
Bằng cách phục hồi tính chất của acid đã sử dụng, chu trình acid được duy trì liên tục. Trong quá trình tái chế, sản phẩm phụ là sắt(III) oxide có thể thu hồi và sử dụng trong nhiều mục đích công nghiệp.
Sản xuất các hợp chất hữu cơ
Một ứng dụng quan trọng khác của acid hydrochloric là trong sản xuất các hợp chất hữu cơ như vinyl chloride và dichloroethan để sản xuất PVC. Quá trình này sử dụng acid từ các nhà sản xuất chứ không phải từ thị trường tự do. Các hợp chất hữu cơ khác được sản xuất từ HCl như bisphenol A để sản xuất polycarbonat, than hoạt tính, và acid ascorbic, cũng như trong một số sản phẩm của ngành dược phẩm.
- 2 CH2=CH2 + 4 HCl + O2 → 2 ClCH2CH2Cl + 2 H2O
- gỗ + HCl + nhiệt → than hoạt tính
Sản xuất các hợp chất vô cơ
Nhiều sản phẩm có thể được sản xuất từ acid hydrochloric qua phản ứng acid-base để tạo ra các hợp chất vô cơ. Chúng bao gồm các hóa chất xử lý nước như sắt(III) chloride và polyaluminium chloride (PAC).
- Fe2O3 + 6 HCl → 2 FeCl3 + 3 H2O (sắt (III) chloride từ magnetit)
Cả sắt (III) chloride và PAC đều được sử dụng như keo tụ và chất đông tụ để lắng các thành phần trong quá trình xử lý nước thải, sản xuất nước uống và giấy.
Các hợp chất vô cơ khác được sản xuất bằng HCl như calci chloride, nickel(II) chloride dùng cho mạ điện và kẽm chloride cho công nghiệp mạ và pin.
- CaCO3 + 2 HCl → CaCl2 + CO2 + H2O (calci chloride từ đá vôi)
- Zn(s) + 2 HCl → ZnCl2 + H2(g)
Điều chỉnh và cân bằng pH
Acid hydrochloric có thể sử dụng để điều chỉnh tính bazơ của dung dịch.
- OH + HCl → H2O + Cl
Trong ngành công nghiệp yêu cầu độ tinh khiết cao như thực phẩm, dược phẩm và nước uống, axit hydrocloric chất lượng cao được sử dụng để điều chỉnh độ pH của nước cần xử lý. Trái lại, trong các lĩnh vực không đòi hỏi độ tinh khiết cao như công nghiệp chung, axit hydrocloric loại công nghiệp chỉ cần đảm bảo đủ để trung hòa nước thải và xử lý nước cho hồ bơi.
Tái sinh thông qua trao đổi ion
Axit HCl chất lượng cao được sử dụng để tái sinh các hạt nhựa trao đổi ion. Quá trình trao đổi cation phổ biến giúp loại bỏ các ion như Na và Ca từ dung dịch nước, tạo thành nước sạch giảm khoáng. Axit này cũng được sử dụng để rửa cation từ các loại nhựa.
- Na được thay thế bằng H
- Ca bị thay thế bằng 2 H
Các quá trình trao đổi ion và sử dụng nước khử khoáng phổ biến trong nhiều ngành công nghiệp, bao gồm sản xuất nước uống và ngành công nghiệp thực phẩm.
Ứng dụng đa dạng



Acid HCl có nhiều ứng dụng như làm sạch da, vệ sinh nhà cửa, và xây dựng. Trong việc khai thác dầu, acid HCl thường được sử dụng để làm sạch giếng khoan và tạo ra các khoảng trống lớn hơn. Việc hóa giếng khoan bằng acid là một quá trình phổ biến trong ngành công nghiệp dầu khí. Khi pha trộn acid hydrochloric nồng độ cao và acid nitric theo tỉ lệ 1:3, chúng có khả năng hòa tan vàng và bạch kim.
Một số ứng dụng của acid HCl trong sản xuất thực phẩm gồm các thành phần như aspartame, fructose, acid citric, lysine, thủy phân protein thực vật và sản xuất gelatin. Acid HCl loại thực phẩm (an toàn cho con người) có thể được sử dụng trong sản phẩm cuối cùng khi cần thiết.
Trong ngữ cảnh của sinh vật
Acid dạ dày là một trong những chất chủ yếu được tiết ra từ bên trong dạ dày. Nó chứa chủ yếu acid hydrochloric và tạo môi trường axit trong dạ dày với pH từ 1 đến 2.
Ion chlor (Cl) và hydro (H) được tiết ra riêng lẻ từ vùng đáy vị của dạ dày (stomach fundus) bởi các tế bào niêm mạc dạ dày vào hệ tiết dịch gọi là tiểu quản (canaliculi), trước khi chúng đi vào lòng ống dạ dày (lumen).
Acid dạ dày đóng vai trò chống lại các vi sinh vật để ngăn ngừa nhiễm trùng và là một yếu tố quan trọng trong quá trình tiêu hóa thức ăn. pH thấp trong dạ dày gây biến tính các protein, làm cho chúng dễ bị phân hủy bởi các enzym tiêu hóa như pepsin. pH thấp cũng kích hoạt tiền enzym pepsinogen thành enzyme pepsin bằng cách tự cắt tự làm sạch (self-cleavage). Sau khi rời khỏi dạ dày, acid hydrochloric trong dịch tiêu hóa bị natri bicarbonat trong tá tràng vô hiệu hóa.
Dạ dày tự bảo vệ mình khỏi acid mạnh bằng cách tạo ra một lớp chất nhầy mỏng để bảo vệ và tiết ra dịch tiết tố để tạo ra lớp đệm natri bicarbonat. Loét dạ dày có thể xảy ra khi các cơ chế này bị suy yếu. Các thuốc kháng histamin và các chất ức chế bơm proton (proton pump inhibitor) có thể ức chế việc tiết acid trong dạ dày, và các chất kháng axit được sử dụng để trung hòa axit có mặt trong dạ dày.
Nguy hiểm

| Các nhãn hàng hóa nguy hiểm | |
|---|---|

Acid hydrochloric nồng đặc có thể bay hơi, tạo thành sương mù acid. Cả dạng sương mù và dung dịch đều có thể gây ảnh hưởng ăn mòn lên các mô con người, gây tổn thương cho hệ hô hấp, mắt, da và ruột. Khi pha acid hydrochloric với các chất oxy hóa như natri hypochlorit (NaOCl) hoặc kali permanganat (KMnO4), sẽ giải phóng khí clo độc hại.
- NaOCl + 2 HCl → H2O + NaCl + Cl2
- 2 KMnO4 + 16 HCl → 2 MnCl2 + 8 H2O + 2 KCl + 5 Cl2
Trang bị đầy đủ đồ bảo hộ như găng tay cao su, kính bảo hộ và quần áo, giày chống hóa chất để bảo vệ người lao động trước các tác động của acid.
Mức độ nguy hiểm của dung dịch acid hydrochloric phụ thuộc vào nồng độ. Bảng dưới đây thể hiện phân loại acid theo tiêu chuẩn của EU.
| Nồng độ khối lượng |
Phân loại | Nhóm R |
|---|---|---|
| 10–25% | Kích thích (Xi) | [R36/37/38] - gây kích thích mắt, hệ hô hấp và da |
| > 25% | Ăn mòn (C) | R34 - gây bỏng R37 - gây kích thích hệ hô hấp |
Cơ quan bảo vệ môi trường Hoa Kỳ xếp acid hydrochloric vào nhóm chất độc. Số hiệu UN quốc tế cho acid hydrochloric là 1789.
- Nước cường toan
- Hydro clorua
- Muối clorua
Liên kết bên ngoài
- Acid hydrochloric trong Từ điển bách khoa Việt Nam
(tiếng Anh)
- Hydrochloric acid (hợp chất hóa học) tại Encyclopædia Britannica (tiếng Anh)
- Hydrogen chloride (hợp chất hóa học) - Hydro clorua tại Encyclopædia Britannica (tiếng Anh)
- Hydrochloric acid-d NIST WebBook
- Thông tin về an toàn
- Health Effects Notebook cho Các Chất Ô Nhiễm Khí Nguy Hiểm Tóm tắt các tác động sức khỏe theo EPA ngày 25/4/2016
- “Hydrochloric acid MSDS bởi American Bioanalytical - Acid hydrochloric MSDS theo phân tích sinh học của American Bioanalytical, Inc., Hoa Kỳ” (PDF) (bằng tiếng Anh). American Bioanalytical, Inc. Bản gốc (PDF) lưu trữ ngày 7 tháng 7 năm 2011. Truy cập ngày 31 tháng 10 năm 2004.
- Hydrochloric acid, 33 - 40%: Acid hydrochloric MSDS theo Học viện công nghệ Georgia
- Xử lý đúng cách khi tiếp xúc với acid theo Minh Đức - Thi Trân - Lê Phương. VnExpress Thứ năm, 31/3/2016 | 00:01 GMT+7
| Tiêu đề chuẩn |
|
|---|
Hợp chất hydro |
|---|
Hợp chất chlor |
|---|
Sinh lý học ống tiêu hóa |
|---|
Chất thay thế máu và dịch truyền (B05) |
|---|
| Chủ đề Hóa học |
