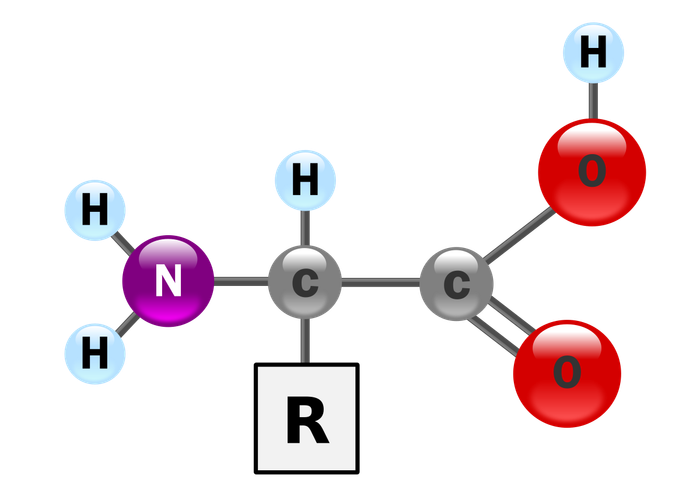
Amino acid, hay còn gọi là acid amin (xuất phát từ danh xưng Pháp ngữ acide aminé), là các hợp chất hữu cơ sinh học quan trọng với nhóm chức amin (-NH2) và acid carboxylic (-COOH), cùng với một nhóm bên (side-chain; nhóm R) đặc trưng cho mỗi amino acid. Các nguyên tố chính của amino acid bao gồm carbon, hydro, oxy và nitơ, và có thể có thêm các nguyên tố khác trong nhóm bên. Hiện có khoảng 500 loại amino acid được biết đến và được phân loại theo nhiều tiêu chí khác nhau. Chúng có thể được phân loại dựa trên vị trí của nhóm chức trong cấu trúc chính như alpha- (α-), beta- (β-), gamma- (γ-) hoặc delta- (δ-) amino acid; các phân loại khác có thể dựa vào mức độ phân cực, pH, và kiểu nhóm bên (như hợp chất không vòng, hợp chất acyclic, tính thơm, chứa hydroxyl hoặc lưu huỳnh, vv.). Trong protein, amino acid là thành phần chiếm số lượng nhiều thứ hai (sau nước) trong cơ, tế bào và mô. Ngoài protein, amino acid đóng vai trò quan trọng trong nhiều quá trình sinh học như vận chuyển chất dẫn truyền thần kinh và tổng hợp sinh học.
Trong hóa sinh học, amino acid đều có nhóm amin và nhóm acid carboxylic liên kết với nguyên tử carbon alpha đầu tiên, và được gọi là 2-, alpha-, hoặc α-amino acid (với công thức tổng quát H2NCHRCOOH trong phần lớn các trường hợp, với R là một nhóm hữu cơ gọi là 'mạch bên'); thường khi nhắc đến 'amino acid' là nói đến hợp chất hóa học này. Có 22 amino acid cấu thành protein, chúng kết hợp thành các chuỗi peptide ('polypeptide') để tạo ra các đơn vị của nhiều loại protein. Tất cả chúng đều là L-đồng phân (các đồng phân 'thuận tay trái'), mặc dù một số ít D-amino acid ('thuận tay phải') xuất hiện trong vỏ tế bào vi khuẩn, như chất điều biến neuron (neuromodulator; D-serine), và trong một số kháng sinh. 20 amino acid sinh protein được mã hóa trực tiếp bởi bộ ba mã hóa codon trong mã di truyền và được coi là những amino acid 'chuẩn'. Ba amino acid khác ('không chuẩn' hoặc 'không chính tắc') bao gồm selenocysteine (xuất hiện ở nhiều sinh vật nhân sơ và hầu hết sinh vật nhân thực, nhưng không do DNA mã hóa trực tiếp), pyrrolysine (chỉ thấy ở một số vi khuẩn cổ và một loại vi khuẩn) và N-formylmethionine (amino acid khởi đầu của protein trong vi khuẩn, ty thể, và lục lạp). Pyrrolysine và selenocysteine được mã hóa qua một số codon khác nhau; ví dụ, selenocysteine được mã hóa bởi codon kết thúc (stop codon) và yếu tố SECIS (SECIS element). Codon–tRNA không tự nhiên cũng được sử dụng để 'mở rộng' mã di truyền và tạo ra các protein đặc biệt chứa các amino acid không chuẩn.
Nhiều amino acid chuẩn cũng như các amino acid không chuẩn đóng vai trò quan trọng khác trong cơ thể bên cạnh việc cấu thành protein. Ví dụ, trong não người, glutamat (acid glutamic chuẩn) và acid gamma-amino-butyric ('GABA', acid gamma-amino không chuẩn) lần lượt là chất dẫn truyền thần kinh kích thích và ức chế (excitatory and inhibitory neurotransmitters); hydroxyproline (một thành phần chính trong collagen của mô liên kết) được tổng hợp từ proline; amino acid chuẩn glycine dùng để tổng hợp porphyrin trong hồng cầu; và amino acid không chuẩn carnitine tham gia vào quá trình vận chuyển lipid.
Có 9 amino acid thiết yếu cho cơ thể người vì chúng không thể được tổng hợp từ các hợp chất khác trong cơ thể. Do đó, cơ thể cần cung cấp các amino acid này qua chế độ ăn uống. Một số amino acid thiết yếu cũng có thể trở thành thiết yếu theo điều kiện, nghĩa là chúng không nhất thiết phải có trong chế độ ăn hàng ngày, nhưng cần thiết cho những người không tự tổng hợp đủ lượng. Các amino acid thiết yếu cũng có thể khác nhau tùy thuộc vào từng loài.
Vì vai trò quan trọng sinh học của chúng, amino acid là những dưỡng chất thiết yếu và thường được sử dụng trong các sản phẩm bổ sung dinh dưỡng, phân bón và công nghệ thực phẩm. Chúng cũng được áp dụng trong các ngành công nghiệp như sản xuất thuốc, nhựa phân hủy sinh học (biodegradable plastic) và các chất xúc tác bất đối xứng (chiral catalysts).
Lịch sử
Vài amino acid đầu tiên được phát hiện vào đầu thế kỷ 19. Vào năm 1806, hai nhà hóa học người Pháp Louis-Nicolas Vauquelin và Pierre Jean Robiquet đã tách chiết một hợp chất từ măng tây (asparagus) và đặt tên là asparagine, trở thành amino acid đầu tiên được phát hiện. Cystine được phát hiện vào năm 1810, mặc dù monome của nó, cysteine, chỉ được tìm ra vào năm 1884. Glycine và leucine được phát hiện vào năm 1820. Amino acid cuối cùng trong số 20 amino acid phổ biến, threonine, được William Cumming Rose phát hiện vào năm 1935, ông cũng xác định các amino acid thiết yếu và thiết lập mức nhu cầu tối thiểu hàng ngày của amino acid cho sự phát triển tối ưu.
Thuật ngữ amino acid trong tiếng Anh bắt đầu được sử dụng từ năm 1898. Các nhà hóa học đã phát hiện protein chứa amino acid thông qua các enzym tiêu hóa hoặc thủy phân acid. Năm 1902, Emil Fischer và Franz Hofmeister đã đề xuất rằng protein được hình thành từ liên kết giữa nhóm amin của một amino acid với nhóm carboxyl của amino acid kế bên, tạo thành một chuỗi thẳng mà Fischer gọi là 'peptide'.
Cấu trúc tổng quát
Cấu trúc minh họa ở đầu trang cho thấy R đại diện cho nhóm bên đặc trưng của từng amino acid. Nguyên tử carbon ngay cạnh nhóm carboxyl được gọi là carbon-α. Các amino acid có nhóm amin liên kết trực tiếp với carbon alpha được gọi là amino acid alpha. Một số amino acid như proline có amin bậc 2 và còn được gọi là 'imin acid'.
Đồng phân
Amino acid alpha là loại amino acid phổ biến nhất trong tự nhiên, với đồng phân-L là dạng thường gặp nhất. Carbon alpha có tính bất đối xứng (chirality), trừ glycine, vì nó có hai nguyên tử hydro giống nhau quanh carbon alpha. Do đó, tất cả các amino acid alpha ngoại trừ glycine chỉ có thể tồn tại dưới dạng hai đồng phân đối quang (enantiomer) L và D, chúng là hình phản chiếu của nhau. Tất cả amino acid trong protein đều là dạng L được tổng hợp tại ribosome, trong khi dạng D thường xuất hiện trong các protein do enzym hậu dịch mã sản xuất và sau đó được chuyển tới mạng lưới nội chất, ví dụ như dạng D xuất hiện ở sinh vật lạ ốc nón sống ở biển. Thành tế bào vi khuẩn cũng chứa nhiều dạng D, và serine D có thể hoạt động như chất dẫn truyền thần kinh trong não. Amino acid D còn được sử dụng trong kỹ thuật triệt quang (racemic crystallography) để tạo ra các tinh thể đối xứng, giúp xác định cấu trúc protein một cách chính xác và dễ dàng hơn. Việc phân loại amino acid thành dạng L hoặc D không dựa vào hoạt động quang phổ của chúng mà dựa vào hoạt động quang phổ của đồng phân glyceraldehyde; glyceraldehyde D là hữu tuyền (dextrorotatory), trong khi glyceraldehyde L là tả tuyền (levorotatory). Ký hiệu S và R được sử dụng để mô tả cấu trúc tuyệt đối của amino acid. Hầu hết các amino acid có carbon α là S, với cysteine là R và glycine có tính chất đối xứng. Cysteine có mạch bên ở vị trí 3D giống các amino acid khác nhưng có ký tự R vì mạch bên của nó chứa sulfur, một nguyên tử có số nguyên tử cao hơn nhóm carboxyl. Các amino acid khác là S do mạch bên của chúng có số nguyên tử thấp hơn nhóm carboxyl.
Mạch bên
Amino acid α là những amino acid có nguyên tử nitơ liên kết với nguyên tử carbon ngay bên cạnh nhóm carboxyl, tạo thành cấu trúc con N–C–CO2. Nếu amino acid có cấu trúc con là N–C–C–CO2 thì được gọi là amino acid β. Tương tự, amino acid γ có cấu trúc con là N–C–C–C–CO2, và tiếp tục như vậy.
Amino acid thường được phân loại thành bốn nhóm chính dựa trên tính chất hóa học của mạch bên. Mạch bên có thể làm cho amino acid trở thành acid yếu, base yếu, hoặc chất ưa nước nếu nó phân cực, hoặc chất kị nước nếu nó không phân cực. Các 'amino acid chuỗi nhánh' có mạch bên không vòng và thẳng bao gồm leucine, isoleucine và valine. Proline là amino acid proteinogenic duy nhất có mạch bên liên kết với nhóm amin α, đồng thời cũng là amino acid proteinogenic duy nhất có amin bậc 2 tại vị trí carbon α. Về mặt hóa học, proline có thể được coi là acid imin vì nó không có nhóm amin bậc 1, nhưng nó vẫn được gọi là amino acid trong danh pháp hóa sinh và còn được gọi là 'amino acid alpha alkyl hóa N'.
Liên kết ngoài
- Molecular Expressions: The Amino Acid Collection - Cung cấp thông tin chi tiết và hình ảnh về từng amino acid.
- Amino acid thứ 22 Lưu trữ ngày 2005-12-15 tại Wayback Machine - Ohio State công bố phát hiện amino acid thứ 22.
- Tính chất amino acid Lưu trữ ngày 2007-09-27 tại Wayback Machine - Công cụ để tìm hiểu ý nghĩa của các đột biến.
- Tổng hợp acid amin và dẫn xuất
- Amino acid thuận tay phải bị bỏ lại Lưu trữ ngày 2007-09-30 tại Wayback Machine
