Axít carboxylic là một loại axít hữu cơ có nhóm chức carboxyl. Công thức chung của loại axít này là R-C(=O)-OH, thỉnh thoảng được viết dưới dạng R-COOH hoặc R-CO2H, trong đó R- có thể là nguyên tử hydro hoặc một nhóm hydrocarbon phức tạp hơn.
Axít carboxylic xuất hiện dưới nhiều hình thức trong cuộc sống, chẳng hạn như amino acid (đơn vị cấu tạo chính của protein) hoặc axít acetic (trong giấm ăn). Khi mất đi một proton (H), nhóm chức carboxyl biến thành anion carboxylate.
Đặc điểm vật lý
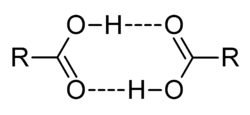
Khả năng hòa tan
Axít carboxylic có tính phân cực mạnh. Với phân cực âm từ nguyên tử oxy trong nhóm carbonyl (-C=O) và phân cực dương từ nguyên tử hydro trong nhóm hydroxy (-OH), các axít này có thể tạo liên kết hydro với nhau và thường xuất hiện dưới dạng dimer trong các dung môi không phân cực. Các axít carboxylic nhỏ (1 đến 5 nguyên tử carbon) có thể hòa tan trong nước. Ngược lại, các axít carboxylic lớn hơn khó hòa tan trong nước vì tính kỵ nước tăng khi độ dài chuỗi alkyl lớn. Các axít lớn thường hòa tan trong dung môi có tính phân cực yếu hơn như ether hay alcohol. Khi phản ứng với dung dịch sodium hydroxide, axít carboxylic, dù lớn hay nhỏ, sẽ tạo ra muối natri hòa tan trong nước.
Nhiệt độ sôi
Axít carboxylic thường có nhiệt độ sôi cao hơn nước hoặc alcohol nhờ diện tích bề mặt lớn và liên kết hydro giữa các dimer ổn định hơn. Để bay hơi, cần một lượng nhiệt đáng kể để phá vỡ liên kết giữa các dimer hoặc khiến toàn bộ dimer bay hơi. Ví dụ, ethanol C2H5OH sôi ở 78,3°C, trong khi axít acetic CH3COOH sôi ở 118°C.
Tính axít
Theo lý thuyết axít-base Bronsted-Lowry, axít carboxylic được phân loại là axít vì nó có khả năng nhường proton H. Đây là một trong những loại axít phổ biến trong hóa học hữu cơ.
Axít carboxylic là một axít yếu. Trong môi trường nước, nó phân li thành cation H3O và anion RCOO nhưng với tỷ lệ rất thấp. Ví dụ, ở nhiệt độ phòng thí nghiệm, chỉ có 0,4% axít acetic trong 1 mol dung dịch bị phân li.
RCOOH ↔ RCOO- + H+
Trong một phân tử axít carboxylic, nếu có các nguyên tố hoặc nhóm chức hút electron như fluor hay clo, axít carboxylic sẽ mạnh hơn. Ví dụ, hằng số pKa của axít formic là 3.75. Nhưng khi thay nhóm C-H của axít formic bằng C-CF3 để tạo thành axít trifluoroacetic, pKa giảm xuống còn 0.23, cho thấy tính axít mạnh hơn. Ngược lại, nếu phân tử axít carboxylic có các nguyên tố hoặc nhóm chức nhường electron, axít carboxylic sẽ yếu hơn. Ví dụ, thay nhóm C-H của axít formic bằng C-CH3 để tạo axít acetic, pKa tăng từ 3.75 lên 4.76, cho thấy tính axít yếu hơn.
Mùi hương
Các axít carboxylic thường phát ra mùi chua và nồng. Ngược lại, các ester – dạng biến thể của axít carboxylic – thường tỏa ra mùi hương dễ chịu và được ưa chuộng trong sản xuất nước hoa.
Các đặc điểm nhận diện
Phương pháp quang phổ hồng ngoại giúp nhận diện axít carboxylic hoặc nhóm carboxyl trong mẫu thử. Dao động của liên kết C=O (nhóm carbonyl) tạo ra một đỉnh hấp thụ rõ ràng trong vùng sóng khoảng 1680 đến 1725 cm. Đồng thời, dao động của liên kết O-H (nhóm hydroxy) tạo ra một đỉnh rộng trong vùng sóng từ 2500 đến 3000 cm. Trong phương pháp cộng hưởng từ hạt nhân hydro-1, lý thuyết dự đoán rằng nguyên tử hydro của nhóm hydroxy sẽ cho tín hiệu trong khoảng 10-13 ppm. Tuy nhiên, thực tế thường thấy kết quả không rõ ràng do axít carboxylic dễ dàng trao đổi với nước, gây khó khăn trong việc đo đạc chính xác.
Tính chất hóa học
- Tính axít: làm đổi màu quỳ tím từ xanh thành đỏ. Phản ứng với kim loại hoạt động, dung dịch base và muối:
- CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O
- 2CH3COOH + Mg → (CH3COO)2Mg + H2↑
- Phản ứng với rượu tạo ester và nước (cần có xúc tác H)
- CH3COOH + CH3-CH2-OH ↔ CH3-C(O)-O-CH2-CH3 + H2O
- Để phản ứng hoàn tất, cần sử dụng acid sulfuric H2SO4 đặc làm xúc tác để hút nước
Phương pháp điều chế
- Oxy hóa rượu etylic bằng không khí chứa oxy với sự trợ giúp của men giấm.
- CH3-CH2-OH + O2 → CH3COOH + H2O
- Tổng hợp từ axetylen:
- C2H2 + H2O → CH3CHO (cần xúc tác với Thủy ngân Sunfat ở 80 °C)
- CH3CHO + 1/2O2 → CH3COOH (cần xúc tác với Mn)
- Thêm một phương pháp điều chế khác:
- Đầu tiên, oxy hóa rượu:
- R-CH2-OH + O2 → R-CHO + H2O
- Tiếp theo, oxy hóa aldehyde thu được:
- R-CHO + [O] → R-COOH
Tên gọi
Tên gọi phổ biến của các acid carboxylic thường dựa trên nguồn gốc phát hiện ra chúng, ví dụ như: acid formic, acid valeric, v.v.
Danh sách các acid carboxylic no đơn chức với cấu trúc mạch thẳng.
| Số nguyên tử Carbon | Tên thông dụng | Danh pháp IUPAC | Công thức cấu tạo | Thường có trong |
|---|---|---|---|---|
| 1 | Acid formic | Acid methanoic | HCOOH | Nọc của côn trùng (đặc biệt là kiến - formica) |
| 2 | Acid acetic | Acid ethanoic | CH3COOH | Giấm ăn |
| 3 | Acid propionic | Acid propanoic | CH3CH2COOH | Các sản phẩm phân hủy của đường |
| 4 | Acid butyric | Acid butanoic | CH3(CH2)2COOH | Bơ ôi |
| 5 | Acid valeric | Acid pentanoic | CH3(CH2)3COOH | Cây nữ lang (Valeriana officinalis) |
| 6 | Acid caproic | Acid hexanoic | CH3(CH2)4COOH | Mỡ động vật, Vani |
| 7 | Acid enanthic | Acid heptanoic | CH3(CH2)5COOH | |
| 8 | Acid caprylic | Acid octanoic | CH3(CH2)6COOH | |
| 9 | Acid pelargonic | Acid nonanoic | CH3(CH2)7COOH | |
| 10 | Acid capric | Acid decanoic | CH3(CH2)8COOH | |
| 12 | Acid lauric | Acid dodecanoic | CH3(CH2)10COOH | Có nhiều trong dầu dừa |
| 18 | Acid stearic | Acid octadecanoic | CH3(CH2)16COOH | Có nhiều trong mỡ bò |
Ứng dụng
Acid axetic
Acid acetic được sử dụng trong việc tổng hợp các loại polymer như polivinyl axetat và xenlulozơ axetat. Nó còn là nguyên liệu chính trong ngành nông dược để sản xuất thuốc diệt cỏ natri monocloacetat và các chất kích thích tăng trưởng cũng như làm rụng lá như 2,4-D và 2,4,5-T. Trong công nghiệp nhuộm, acid acetic được dùng để tạo ra nhôm acetat, crôm acetat và sắt acetat, cũng như trong sản xuất các hóa chất phổ biến như aceton, etyl acetat và isoamyl acetat.
Dung dịch acid acetic với nồng độ 2-5% được tạo ra từ quá trình lên men giấm, từ dung dịch đường hoặc rượu etylic, và được sử dụng như giấm ăn.
Acid lauric, acid panmitic, acid stearic và acid oleic
Các acid lauric (n-C11H23COOH), panmitic (n-C15H31COOH), stearic (n-C17H35COOH) và oleic (cis-CH3[CH2]7CH=CH[CH2]7COOH) có mặt trong dầu mỡ động vật và thực vật dưới dạng triester của glixerol. Muối natri của những acid này thường được dùng để sản xuất xà phòng, và acid panmitic cũng như stearic thường được trộn với parafin để làm nến.
Acid benzoic
Acid benzoic (tên khoa học: acid benzoic; còn gọi là acid phenyl formic, acid benzencarboxylic), có công thức C6H5COOH. Đây là hợp chất acid carboxylic thơm đơn giản nhất, tồn tại dưới dạng tinh thể màu trắng, hình kim hoặc vảy. Nó có điểm nóng chảy 121,7°C, điểm sôi 249°C, và điểm hóa hơi 100°C. Acid benzoic tan trong dung môi hữu cơ và nước nóng. Có thể điều chế bằng cách oxi hóa toluen với acid nitric hoặc acid cromic, hoặc bằng oxi trong không khí ở pha lỏng, hay bằng cách decarboxyl hóa anhydride phtalic trong pha khí ở 340°C với chất xúc tác ZnO. Acid benzoic được sử dụng trong bảo quản thực phẩm, thuốc lá, keo dính, sản xuất phẩm nhuộm, dược phẩm và chất tạo hương. Trong y học, nó được dùng làm thuốc sát trùng và diệt nấm.
Acid oxalic HOOC-COOH và acid malonic HOOC-CH2-COOH
- Acid oxalic phổ biến trong thực vật dưới dạng muối, và có mặt trong nước tiểu của người và động vật dưới dạng calci oxalat. Acid oxalic có tính khử và phản ứng oxy hóa nó thành CO2 bằng KMnO4 thường được dùng trong phân tích hóa học.
- Acid malonic chứa nhóm methylen có tính linh động, dễ tham gia vào phản ứng ngưng tụ kiểu croton và dễ bị decarboxyl hóa bởi nhiệt để tạo ra acid acetic. Ester diethyl malonate CH2(COOC2H5)2 được ứng dụng trong tổng hợp hữu cơ, đặc biệt là tổng hợp acid carboxylic với gia tăng 2 carbon từ dẫn xuất halogen.
