


| Acid sulfuric | |
|---|---|
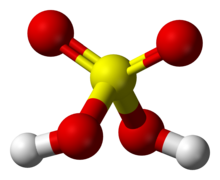
Cấu trúc phân tử của acid sulfuric | |
| Tổng quan | |
| Danh pháp IUPAC | Acid sulfuric |
| Tên khác | Dầu sulfate, Hydro sulfate |
| Công thức phân tử | H2SO4 |
| Phân tử gam | 98,078 g/mol |
| Biểu hiện | Dầu trong suốt, không màu, |
| Số CAS | [7664-93-9] |
| Thuộc tính | |
| Tỷ trọng và pha | 1,84 g/cm³, lỏng |
| Độ hòa tan trong nước | Có thể trộn lẫn (tỏa nhiệt) |
| Nhiệt độ nóng chảy | 10 °C, 283 K |
| Điểm sôi | 338C (dung dịch acid 98%) |
| pKa | -3,0 2,0 |
| Độ nhớt | 26,7 cP ở 20 °C |
| Khác | |
| MSDS | MSDS ngoài |
| Các nguy hiểm chính | Tính ăn mòn và hấp thụ nước mạnh |
| NFPA 704 | |
| Điểm bắt lửa | Không cháy |
| Rủi ro/An toàn | R: 35 S: 26, 30, 45 |
| Số RTECS | WS5600000 |
| Dữ liệu hóa chất bổ sung | |
| Cấu trúc & thuộc tính | n εr, v.v. |
| Dữ liệu nhiệt động lực | Các trạng thái rắn, lỏng, khí |
| Dữ liệu quang phổ | UV, IR, NMR, MS |
| Các hợp chất liên quan | |
| Các hợp chất tương tự | acid sulfurơ Acid selenic Acid teluric acid polonic acid hydrochloric acid nitric acid phosphoric |
| Các hợp chất liên quan | Hydro sulfide acid peroxymonosulfuric |
| Ngoại trừ có thông báo khác, các dữ liệu được lấy ở 25 °C, 100 kPa Thông tin về sự phủ nhận và tham chiếu | |
Axit sulfuric (H2SO4), còn được gọi là vitriol (tên thường dùng để chỉ muối sulfat, đôi khi dùng để chỉ loại axit này), là một axit vô cơ chứa lưu huỳnh, oxy và hydro, với công thức hóa học H2SO4. Đây là một chất lỏng không màu, không mùi, có độ nhớt cao và dễ hòa tan trong nước, với phản ứng tỏa nhiệt mạnh.
Tính ăn mòn của axit sulfuric chủ yếu do tính acid mạnh của nó, và ở nồng độ cao, nó còn có tính chất khử nước và oxy hóa. Nó cũng có khả năng hút ẩm, dễ dàng hấp thụ hơi nước từ không khí. Khi tiếp xúc, axit sulfuric có thể gây bỏng hóa chất nghiêm trọng và bỏng nhiệt thứ cấp; nó rất nguy hiểm ngay cả ở nồng độ trung bình.
Axit sulfuric là một hóa chất công nghiệp quan trọng, và sản lượng của nó thường được dùng để đánh giá sức mạnh công nghiệp của một quốc gia. Nó được sản xuất bằng nhiều phương pháp khác nhau, như quy trình tiếp xúc, quy trình axit sulfuric ướt, quy trình buồng chì và một số phương pháp khác.
Ứng dụng chính của axit sulfuric là trong sản xuất phân bón. Nó cũng đóng vai trò quan trọng trong ngành công nghiệp hóa chất. Các ứng dụng chính bao gồm sản xuất phân bón (và chế biến khoáng sản khác), lọc dầu, xử lý nước thải, hóa muối các kim loại mạnh hơn Cu và tổng hợp hóa học. Nó còn được dùng trong chất tẩy rửa có tính acid trong nước, làm chất điện phân trong pin axit-chì và trong nhiều loại chất tẩy rửa khác.
Liên kết ngoài
- Thông tin MSDS về axit sulfuric Lưu trữ ngày 30 tháng 10 năm 2005 tại Wayback Machine
- Danh sách các nhà cung cấp hóa chất của Chemexper
- Phân tích thị trường công nghiệp axit sulfuric
Tham khảo
 Cổng thông tin Thiên nhiên
Cổng thông tin Thiên nhiên- Handbook of Chemistry and Physics, ấn bản lần thứ 71, CRC Press, Ann Arbor, Michigan, 1990.
- N. N. Greenwood, A. Earnshaw, Hóa học các nguyên tố, trang 837–845, Pergamon Press, Oxford, Vương quốc Anh, 1984. ISBN 0-08-022057-6.
- Philip J. Chenier, Tổng quan về Hóa học Công nghiệp, trang 45–57, John Wiley & Sons, New York, 1987. ISBN 0-471-01077-4.
Hợp chất chứa nhóm chức Sulfat (SO2− 4) |
|---|
| H 2SO 4 |
He | ||||||||||||||||||||
| Li 2SO 4 |
BeSO 4 |
B 2S 2O 9 -BO3 +BO3 |
esters ROSO− 3 (RO) 2SO 2 +CO3 +C2O4 |
(NH 4) 2SO 4 [N 2H 5]HSO 4 (NH 3OH) 2SO 4 NOHSO4 +NO3 |
HOSO4 | +F | Ne | ||||||||||||||
| Na2SO4 NaHSO4 |
MgSO4 | Al2(SO4)3 Al2SO4(OAc)4 |
Si | +PO4 | SO2− 4 HSO3HSO4 (HSO4)2 +SO3 |
+Cl | Ar | ||||||||||||||
| K2SO4 KHSO4 |
CaSO4 | Sc2(SO4)3 | TiOSO4 | VSO4 V2(SO4)3 VOSO4 |
CrSO4 Cr2(SO4)3 |
MnSO4 | FeSO4 Fe2(SO4)3 |
CoSO4 Co2(SO4)3 |
NiSO4 Ni2(SO4)3 |
CuSO4 Cu2SO4 [Cu(NH3)4(H2O)]SO4 |
ZnSO4 | Ga2(SO4)3 | Ge | As | +SeO3 | Br | Kr | ||||
| RbHSO4 Rb2SO4 |
SrSO4 | Y2(SO4)3 | Zr(SO4)2 | Nb2O2(SO4)3 | MoO(SO4)2 MoO2(SO4) |
Tc | Ru(SO4)2 | Rh2(SO4)3 | PdSO4 | Ag2SO4 AgSO4 |
CdSO4 | In2(SO4)3 | SnSO4 Sn(SO4)2 |
Sb2(SO4)3 | Te | +IO3 | Xe | ||||
| Cs2SO4 CsHSO4 |
BaSO4 | * | Lu2(SO4)3 | Hf | Ta | WO(SO4)2 | Re2O5(SO4)2 | OsSO4 Os2(SO4)3 Os(SO4)2 |
IrSO4 Ir2(SO4)3 |
Pt2(SO4)5 | AuSO4 Au2(SO4)3 |
Hg2SO4 HgSO4 |
Tl2SO4 Tl2(SO4)3 |
PbSO4 Pb(SO4)2 |
Bi2(SO4)3 | PoSO4 Po(SO4)2 |
At | Rn | |||
| Fr | RaSO4 | ** | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| * | La2(SO4)3 | Ce2(SO4)3 Ce(SO4)2 |
Pr2(SO4)3 | Nd2(SO4)3 | Pm2(SO4)3 | Sm2(SO4)3 | EuSO4 Eu2(SO4)3 |
Gd2(SO4)3 | Tb2(SO4)3 | Dy2(SO4)3 | Ho2(SO4)3 | Er2(SO4)3 | Tm2(SO4)3 | Yb2(SO4)3 | |||||||
| ** | Ac2(SO4)3 | Th(SO4)2 | Pa | U2(SO4)3 U(SO4)2 UO2SO4 |
Np(SO4)2 | Pu(SO4)2 | Am2(SO4)3 | Cm2(SO4)3 | Bk | Cf2(SO4)3 | Es | Fm | Md | No | |||||||
Hợp chất Hydro |
|---|
Hợp chất hydro |
|---|
Hợp chất lưu huỳnh | |
|---|---|
| |
Hợp chất hóa học
|
| Tiêu đề chuẩn |
|
|---|
