Giải Hóa 10 Bài 4: Ôn tập chương 1 là một tài liệu hữu ích giúp học sinh lớp 10 có thêm gợi ý và nhanh chóng trả lời các câu hỏi trong sách Kết nối tri thức, đặc biệt là trang 26 và 27 của Chương 1.
Hóa 10 bài 4: Ôn tập chương 1 được biên soạn một cách khoa học và chi tiết, giúp học sinh rèn luyện kỹ năng giải các bài tập Hóa học và so sánh đáp án một cách thuận tiện, từ đó họ có thể học tốt môn Hóa học 10. Đồng thời, đây cũng là tài liệu hữu ích giúp giáo viên soạn giáo án. Hãy cùng theo dõi giải Hóa 10 trang 27 trong sách Kết nối tri thức.
Giải Bài 4 Hóa học lớp 10 trang 27
Câu hỏi số 1

| A. 19, 20, 39 | B. 20, 19, 39 | C. 19, 20, 19 | D. 19, 19, 20 |
Gợi ý đáp án

Số nguyên tử = số proton = số electron = 19
Số khối = 39 => Số neutron = 39 – 19 = 20

Câu 2
Nguyên tử của nguyên tố nào sau đây có 3 electron ở lớp vỏ ngoài cùng




Gợi ý đáp án
Đáp án C

Cấu hình electron: 1s22s22p63s1
=> Có 1 electron ở lớp vỏ ngoài cùng

Cấu hình electron: 1s22s22p3
=> Có 5 electron ở lớp vỏ ngoài cùng

Cấu hình electron: 1s22s22p63s23p1
=> Có 3 electron ở lớp vỏ ngoài cùng

Cấu hình electron: 1s22s22p2
=> Có 4 electron ở lớp vỏ ngoài cùng
Câu 3
Nguyên tử của nguyên tố kali có 19 electron. Trong trạng thái cơ bản, kali có bao nhiêu orbital chứa electron
| A. 8 | B. 9 | C. 11 | D. 10 |
Gợi ý đáp án
Nguyên tử kali có 19 electron
=> Cấu hình electron: 1s22s22p63s23p64s1
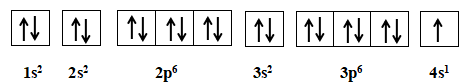
Potassium có 10 orbital chứa electron.
Đáp án D
Câu 4
Nguyên tử của nguyên tố natri (Na) (Z = 11) có cấu hình electron là
| A. 1s22s22p63s2 | B. 1s22s22p6 | C. 1s22s22p63s1 | D. 1s22s22p53s2 |
Gợi ý đáp án
Cấu hình electron: 1s22s22p63s1
Đáp án C
Câu 5
Tổng số proton, neutron và electron trong nguyên tử X là 58. Số hạt mang điện nhiều hơn số hạt không mang điện là 18. X là
| A. Cl | B. Ca | C. K | D. S |
Gợi ý đáp án
Gọi số hạt proton, electron và neutron trong nguyên tử X là p, e, n
Ta có:
Nguyên tử X có tổng số hạt proton, neutron và electron là 58:
=> p + e + n = 58 <=> 2p + n = 58 (vì p = e) (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 18:
=> p + e – n = 18 <=> 2p - n = 18 (2)
Giải phương trình (1), (2)
p = e = 19 và n = 20
=> X là kali
Đáp án C
Câu 6
Nguyên tố clo có Z = 17. Hãy cho biết số lớp electron, số electron ở lớp ngoài cùng, số electron độc thân của nguyên tử clo
Gợi ý đáp án
Nguyên tử clo có Z = 17
Cấu hình electron: 1s22s22p63s23p5
Cấu hình của clo theo orbit
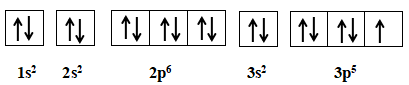
+ Số lớp electron của clo: 3
+ Số electron của clo ở lớp ngoài cùng: 7
+ Số electron độc thân của clo: 1
Câu 7

Gợi ý đáp án
Gọi số khối còn lại là a. Ta có:

Vậy số khối của đồng vị còn lại của Vanadi là 51
Câu 8
Cấu hình electron của:
- Nguyên tử X: 1s22s22p63s23p64s1
- Nguyên tử Y: 1s22s22p63s23p4
a) Mỗi nguyên tử X và Y chứa bao nhiêu electron?
b) Hãy cho biết số hiệu nguyên tử của X và Y.
c) Lớp electron nào trong nguyên tử X và Y có mức năng lượng cao nhất?
d) Mỗi nguyên tử X và Y có bao nhiêu lớp electron, bao nhiêu phân lớp electron?
e) X và Y thuộc nhóm nguyên tố nào trong bảng tuần hoàn?
Đáp án gợi ý
a)
Nguyên tử X có 19 electron
Nguyên tử Y có 16 electron
b)
Nguyên tử X có 19 electron => Số hiệu nguyên tử của X là ZX = 19
Nguyên tử Y có 16 electron => Số hiệu nguyên tử của Y là ZY = 16
c)
Trong nguyên tử X, lớp electron ở mức năng lượng cao nhất là lớp N (n= 4)
Trong nguyên tử Y, lớp electron ở mức năng lượng cao nhất là lớp M (n= 3)
d) Nguyên tử X có:
+ 4 lớp electron (n = 1, 2, 3, 4)
+ 6 phân lớp electron (bao gồm 1s, 2s, 2p, 3s, 3p, 4s)
Nguyên tử Y có:
+ 3 lớp electron (n= 1, 2, 3)
+ 5 phân lớp electron (bao gồm 1s, 2s, 2p, 3s, 3p)
e)
Nguyên tử X có 1 electron ở lớp ngoài cùng (4s1)
=> X là nguyên tử kim loại.
Nguyên tử Y có 6 electron ở lớp ngoài cùng (3s23p4)
=> Y là nguyên tố phi kim.
Câu 9
Nguyên tố X được sử dụng để sản xuất hợp kim nhẹ, bền, được ứng dụng trong nhiều lĩnh vực như hàng không, ô tô, xây dựng, hàng tiêu dùng,… Nguyên tử Y trong dạng YO43- có vai trò quan trọng trong các phân tử sinh học như DNA và RNA. Các tế bào sống sử dụng YO43- để vận chuyển năng lượng. Cấu hình electron của nguyên tử X kết thúc ở phân lớp 3p1. Cấu hình electron của nguyên tử Y kết thúc ở phân lớp 3p3. Viết cấu hình electron của nguyên tử X và Y. Tính số electron trong nguyên tử X và Y. Nguyên tố X và Y có tính kim loại hay phi kim?
Gợi ý đáp án
Nguyên tử nguyên tố X có electron cuối cùng ở phân lớp 3p1
Cấu hình electron của X là: 1s22s22p63s23p1
=> X có 13 electron và X là kim loại (do có 3 electron ở lớp ngoài cùng)
Nguyên tử Y có electron cuối cùng điền vào phân lớp 3p3
Cấu hình electron của Y là: 1s22s22p63s23p3
=> Y có 15 electron và Y là phi kim (do có 5 electron ở lớp ngoài cùng).
Câu 10
Nguyên tử của nguyên tố X có tổng số hạt cơ bản (proton, electron, neutron) là 49, trong đó số hạt không mang điện bằng 53,125% số hạt mang điện. Xác định điện tích hạt nhận, số proton, số electron, số neutron và số khối của X?
Gợi ý đáp án
Gọi số hạt proton, electron và neutron trong nguyên tử X lần lượt là P, E, N (Z = P = E)
Theo đề bài:
Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 49:
=> 2Z + N = 49 (1)
Lại có, số hạt không mang điện bằng 53,125% số hạt mang điện:
=> N = 2Z .53,125/100 (2)
Giải phương trình (1) và (2) ta được:
=> Z = 16 = P = E
N =17
Số khối của nguyên tử X là: Z + N = 16 + 17 = 33
Vậy nguyên tử nguyên tố X có: điện tích hạt nhân là 16+, 16 proton, 16 electron, 17 neutron và có số khối là 33.
