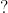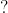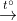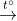Mytour xin giới thiệu đến bạn đọc bộ đề kiểm tra cuối kỳ 2 môn Hóa học lớp 8 cùng đáp án mới nhất, hi vọng thông tin này sẽ hữu ích cho bạn.1. Đề kiểm tra học kì 2 lớp 8 môn Hóa học - Đề số 1
A. Trắc nghiệm
Câu 1. Trong các phản ứng hóa học sau, phương trình nào là phản ứng thế:
A. CaO + H2O → Ca(OH)2
B. Fe + H2SO4 → FeSO4 + H2
C. CaCO3 → CaO + CO2
D. 5O2 + 4P → 2P2O5
Câu 2. Độ hòa tan của khí trong nước thay đổi như thế nào khi:
A. Giảm nhiệt độ và giảm áp suất
B. Tăng nhiệt độ và giảm áp suất
C. Giảm nhiệt độ và tăng áp suất
D. Tăng nhiệt độ và tăng áp suất
Câu 3. Để điều chế oxi trong phòng thí nghiệm, chất nào sau đây được sử dụng:
A. K2O và KMnO4
B. KMnO4 và KClO3
C. H2SO4 và H2O
D. KOH và KClO3
Câu 4. Các chất nào dưới đây có thể hòa tan trong nước:
A. NaCl, AgCl.
B. HNO3, H2SiO3.
C. NaOH, Ba(OH)2.
D. CuO, AlPO4.
Câu 5. Khi hòa tan 5 g muối ăn vào 45 g nước, nồng độ phần trăm của dung dịch sẽ là:
A. 5%
B. 10%
C. 15%
D. 20%
Câu 6. Dãy chất nào hoàn toàn là các oxit:
A. SO2, BaO, P2O5, ZnO, CuO
B. SO2, BaO, KClO3, P2O5, MgO
C. CaO, H2SO4, P2O5, MgO, CuO
D. SO2, CaO, KClO3, NaOH, SO3
Câu 7. Khí hidro phản ứng được với nhóm chất nào sau đây:
A. CuO, FeO, O3
B. CuO, FeO, H2
C. CuO, Fe2O3, H2SO4
D. CuO, CO, HCl
Câu 8. Trong các dãy chất dưới đây, dãy nào khiến quỳ tím chuyển sang màu xanh?
A. KClO3, NaCl, FeSO4, MgCO3.
B. CaO, SO3, BaO, Na2O.
C. Ca(OH)2, KOH, NaOH, Ba(OH)2.
D. HCl, HNO3, H2SO4, H3PO4.
Câu 9. Xét các chất: Na2O, KOH, MgSO4, Ba(OH)2, HNO3, HCl, Ca(HCO3)2. Số lượng oxit, axit, bazơ, muối lần lượt là:
A. 1; 2; 2; 3.
B. 1; 2; 2; 2.
C. 2; 2; 1; 2.
D. 2; 2; 2; 1.
Câu 10. Nồng độ % của dung dịch cho biết điều gì:
A. Số gam chất tan trong 100g nước.
B. Số gam chất tan trong 1000ml dung dịch.
C. Số gam chất tan trong 100ml nước.
D. Số gam chất tan trong 100g dung dịch.
B. Tự luận
Câu 1 (2,0 điểm). Viết phương trình hóa học cho các phản ứng sau:
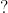
b) Zn + HCl → ? + ?
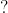
d) Ca + H2O → ? + ?
Câu 2 (4,0 điểm).
1. Xét các oxit: Fe2O3, P2O5, SiO2, Na2O. Xác định oxit nào là oxit bazơ và viết công thức của bazơ tương ứng. Xác định oxit nào là oxit axit và viết công thức của axit tương ứng.
2. Có 3 bình chứa các khí: không khí, O2, H2. Hãy mô tả các phương pháp hóa học để nhận diện các khí này.
Câu 3 (4,0 điểm).
Cho 10,4g hỗn hợp Mg và Fe phản ứng hoàn toàn với dung dịch HCl 0,5M, sinh ra 6,72 lít khí H2 (ở điều kiện tiêu chuẩn).
a) Viết các phương trình hóa học cho phản ứng xảy ra.
b) Tính khối lượng của từng kim loại trong hỗn hợp ban đầu.
c) Tính thể tích dung dịch HCl 0,5M đã sử dụng.
GIẢI ĐÁP CHI TIẾT:
A. Phần trắc nghiệm
1. A
2. C
3. B
4. C
5. B
6. A
7. A
8. C
9. B
10. D
B. Trắc nghiệm
Câu 1:
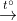
b) Zn + 2HCl → ZnCl2 + H2
d) Ca + 2H2O → Ca(OH)2 + H2 ↑
Câu 2:
a) Oxit bazo: Fe2O3, Na2O
- Các bazơ tương ứng: Fe(OH)3, NaOH
- Các oxit axit: P2O5, SiO2
- Các axit tương ứng: H3PO4, H2SiO3
b) - Đưa từng khí ra khỏi bình, nếu que đóm vẫn cháy và tàn đỏ ở miệng ống dẫn khí thì:
Khí làm tàn đỏ bùng cháy là oxi.
Đốt hai khí còn lại, khí nào cháy với ngọn lửa xanh nhạt trong không khí là H2
Khí còn lại là không khí.
Câu 3:
a) Phương trình phản ứng hóa học
Mg + 2HCl → MgCl2 + H2 (1)
Fe + 2HCl → FeCl2 + H2 (2)
b) 5,6 gam
c) 1,2 lít
2. Đề thi học kì 2 lớp 8 môn Hóa học - Đề số 2
A. Phần trắc nghiệm (2,0 điểm): Chọn câu trả lời đúng trong số các câu hỏi sau:
Câu 1. Trong các dãy chất dưới đây, dãy nào làm quỳ tím chuyển sang màu xanh?
A. KClO3, NaCl, FeSO4, MgCO3.
B. CaO, SO3, BaO, Na2O.
C. Ca(OH)2, KOH, NaOH, Ba(OH)2.
D. HCl, HNO3, H2SO4, H3PO4.
Câu 2. Xem xét các chất: Na2O, KOH, MgSO4, Ba(OH)2, HNO3, HCl, Ca(HCO3)2. Số lượng oxit, axit, bazơ và muối lần lượt là:
A. 1; 2; 2; 3.
B. 1; 2; 2; 2.
C. 2; 2; 1; 2.
D. 2; 2; 2; 1
Câu 3. Nồng độ phần trăm của một dung dịch biểu thị
A. Số gam chất tan có trong 100 gram nước.
B. Số gam chất tan có trong 1000 ml dung dịch.
C. Khối lượng chất tan trong 100 ml nước.
D. Khối lượng chất tan trong 100 gram dung dịch.
Câu 4. Nếu độ tan của KCl ở 30°C là 37, thì khối lượng nước cần bay hơi từ 200g dung dịch KCl 20% để đạt được dung dịch bão hòa là:
A. 52 gam.
B. 148 gam.
C. 48 gam
D. 152 gam
Câu 5. Để tăng độ hòa tan của khí trong nước, bạn cần:
A. Giảm nhiệt độ và giảm áp suất
B. Giảm nhiệt độ và tăng áp suất
C. Tăng nhiệt độ và giảm áp suất
D. Tăng nhiệt độ và tăng áp suất
Câu 6. Để điều chế oxy trong phòng thí nghiệm, chất nào sau đây được sử dụng:
A. K2O và KMnO4
B. KMnO4 và KClO3
C. H2SO4 và H2O
D. KOH và KClO3
Câu 7. Những chất nào sau đây hòa tan trong nước:
A. NaCl, AgCl
B. HNO3, H2SiO3
C. NaOH, Ba(OH)2
D. CuO, AlPO4
Câu 8. Khi hòa tan 5 g muối ăn vào 45 gam nước, nồng độ phần trăm của dung dịch thu được là:
A. 5%
B. 10%
C. 15%
D. 20%
Câu 9. Dãy các chất nào hoàn toàn là oxit:
A. SO2, BaO, P2O5, ZnO, CuO
B. SO2, BaO, KClO3, P2O5, MgO
C. CaO, H2SO4, P2O5, MgO, CuO
D. SO2, CaO, KClO3, NaOH, SO3
Câu 10. Khí hidro có khả năng phản ứng với tất cả các chất thuộc nhóm nào dưới đây:
A. CuO, FeO, O3
B. CuO, FeO, H2
C. CuO, Fe2O3, H2SO4
D. CuO, CO, HCl
B. Phần tự luận (8,0 điểm)
Câu 1. Hoàn thành các phương trình hóa học dưới đây và xác định loại phản ứng của chúng:
K + ? → KOH + H2
Al + O2 → ?
FexOy + O2 → Fe2O3
KMnO4 → ? + MnO2 + O2
Câu 2. Trình bày phương pháp nhận diện các khí sau: Nitơ, hiđro, oxi, cacbon đioxit và metan (CH4). Viết phương trình hóa học nếu có.
Câu 3. Nếu cho 5,4 gam bột nhôm phản ứng hoàn toàn với 400ml dung dịch HCl, hãy xác định các sản phẩm và phương trình phản ứng.
a. Tính toán nồng độ mol/lít của dung dịch HCl đã sử dụng?
b. Khí hidro thu được được dẫn qua bình chứa 32g CuO nung nóng và thu được m gam chất rắn. Tính phần trăm khối lượng của các thành phần trong m?
ĐÁP ÁN CHI TIẾT:
A. Phần trắc nghiệm
1. C
Số 2. B
Số 3. D
Số 4. A
Số 5. C
Số 6. B
Số 7. C
Số 8. B
Số 9. A
Số 10. A
B. Phần trả lời tự luận
Câu hỏi 1:
2K + 2H2O → 2KOH + H2 (Phản ứng thay thế)
4Al + 3O2 → 2Al2O3 (Phản ứng tổng hợp)
4FexOy + (3x - 2y)O2 → 2xFe2O3 (Phản ứng tổng hợp)
2KMnO4 → K2MnO4 + MnO2 + O2 (Phản ứng phân hủy)
(HS sai mỗi phản ứng bị trừ 0,25 điểm)
Câu hỏi 2:
- Sử dụng dung dịch nước vôi trong để phát hiện khí CO2
Phương trình phản ứng: CO2 + Ca(OH)2 → CaCO3 + H2O
- Sử dụng đóm đỏ để nhận diện khí O2
- Dẫn ba khí còn lại qua bột CuO nung nóng, khí nào làm đổi màu CuO thành đỏ gạch là khí H2
Đốt hai khí còn lại, khí nào cháy là CH4, khí còn lại là Nitơ
Câu hỏi 3:
Chuyển đổi 400 ml = 0,4 l
Phương trình hóa học: 2Al + 6HCl → 2AlCl3 + 3H2 (1)
nAl = 5,4 : 27 = 0,2 (mol)
Theo phương trình (1) nHCl = 3nAl = 3 × 0,2 = 0,6 (mol)
CM dung dịch HCl = 0,6 : 0,4 = 1,5M
Theo PTHH (1) nH2 = 3/2nAl = 3 : 2 × 0,2 = 0,3 (mol)
nCuO = 32 : 80 = 0,4 (mol)
Phương trình hóa học: CuO + H2 → Cu + H2O
Trước phản ứng: 0,4 0,3 (mol)
Khi phản ứng: 0,3 0,3 0,3 (mol)
Sau phản ứng: 0,1 0 0,3 (mol)
→mCuO dư = 0,1 × 80 = 8(g)
mCu = 0,3 × 64 = 19,2(g)
Trong mẫu có 8 g CuO dư và 19,2 g Cu
%CuO = 8/27,2 × 100% = 29,4%; %Cu = 70,6%
(Phương pháp khác vẫn được điểm tối đa nếu đúng)
Đây là bài viết của Mytour, hy vọng đã cung cấp thông tin hữu ích cho bạn đọc.