1. Đề thi học sinh giỏi môn Hóa học lớp 8 - Đề số 01
Câu 1:
1. Hình ảnh bên dưới thể hiện hệ thống thiết bị để sản xuất khí X trong phòng thí nghiệm.
a. Khí X là loại khí gì? Nêu nguyên tắc chung để tạo ra khí X bằng thiết bị này.
b. Xác định các chất A và B, đồng thời viết các phương trình phản ứng tương ứng.
2. Thực hiện thí nghiệm với 4 chất rắn Na, Fe, CaO, P2O5 lần lượt vào 4 cốc chứa nước, sau đó cho giấy quỳ tím vào các cốc. Mô tả hiện tượng và viết các phương trình phản ứng nếu có.
Bài 2. (1,5 điểm)
1. Sử dụng phương pháp hóa học để nhận diện các chất rắn màu trắng được lưu trữ trong các lọ không có nhãn, bao gồm: P2O5; CaO; NaCl; Na2O.
2. Viết các phương trình hóa học cho các phản ứng chuyển hóa sau đây (bao gồm cả các điều kiện phản ứng, nếu có):
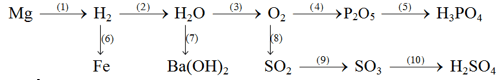
Bài 3. (2,5 điểm)
Hỗn hợp B chứa hai khí: cacbon oxit và hiđro có tỷ khối so với H2 là 10,75. Để hoàn toàn khử m gam Fe3O4 bằng cách nung nóng, cần sử dụng chính xác V lít hỗn hợp B (ở điều kiện tiêu chuẩn). Sau phản ứng, thu được 16,8 gam sắt.
a. Tính phần trăm thể tích của từng khí trong hỗn hợp B.
b. Tính giá trị của V và m.
Bài 4. (1,0 điểm)
Sử dụng khí H2 dư để khử hoàn toàn m gam một oxit sắt, sau phản ứng thu được 5,4 gam nước. Nếu hòa tan toàn bộ lượng kim loại thu được vào dung dịch HCl dư, ta thu được 25,4 gam muối. Xác định công thức của oxit sắt và tính giá trị của m.
Bài 5. (2,0 điểm)
1. Xác định công thức hóa học của hợp chất tạo thành từ sắt và oxi, biết rằng cứ 7 gam sắt sẽ kết hợp với 3 gam oxi.
2. Để hòa tan hoàn toàn 27,84 gam một oxit sắt, cần sử dụng chính xác 480 ml dung dịch HCl 2M. Xác định công thức hóa học của oxit sắt này.
Bài 6. (2,0 điểm)
Cho khí hiđro đi qua ống thủy tinh chứa 20 g bột đồng (II) oxit (màu đen) ở nhiệt độ cao. Sau một thời gian, thu được 16,8 g chất rắn.
a. Mô tả hiện tượng xảy ra trong phản ứng.
b. Tính hiệu suất của phản ứng.
c. Tính thể tích khí hiđro đã tham gia vào quá trình khử đồng (II) oxit ở điều kiện tiêu chuẩn.
Câu 7. (1,5 điểm)
Đưa 4,45 gam hỗn hợp Zn và Mg vào phản ứng với 250 ml dung dịch HCl 2M.
a. Chứng minh rằng sau phản ứng, axit vẫn còn dư.
b. Nếu có 2,24 lít khí thoát ra ở điều kiện tiêu chuẩn, xác định phần trăm khối lượng của từng kim loại trong hỗn hợp ban đầu.
Câu 8. (1,0 điểm)
Nguyên tử của nguyên tố X có tổng số hạt là 40. Trong hạt nhân nguyên tử của X, số hạt mang điện ít hơn số hạt không mang điện là 1 hạt. Xác định số lượng từng loại hạt và tên, ký hiệu hóa học của nguyên tố X.
Câu 9. (2,0 điểm)
1. Hòa tan 10,2 gam hỗn hợp Mg và Al trong dung dịch H2SO4 loãng dư để thu được 11,2 lít khí H2. Tính khối lượng muối sunfat tạo thành.
2. Đốt 14,3 gam hỗn hợp X gồm Mg, Al, Zn trong oxi dư, sau phản ứng hoàn toàn, thu được 22,3 gam hỗn hợp Y gồm ba oxit. Tính thể tích dung dịch HCl 2M tối thiểu cần dùng để hòa tan hỗn hợp Y.
Câu 10. (1,0 điểm)
Độ pH, hay còn gọi là mức độ axit - bazơ, có ảnh hưởng đáng kể đến cơ thể. Để đo độ bazơ của các sản phẩm như bột giặt, sữa tắm và nước rửa chén, người ta thường sử dụng giấy pH có tẩm chất chỉ thị màu. Trong tự nhiên, nhiều thực vật như bắp cải tím, hoa hồng, và hoa râm bụt chứa chất chỉ thị màu. Hãy thiết kế một thí nghiệm để kiểm tra độ kiềm của sữa tắm tại nhà.
Câu 11. (3,0 điểm)
1. Khử hoàn toàn 23,2 gam một oxit kim loại bằng 11,2 lít khí CO (ở điều kiện tiêu chuẩn) ở nhiệt độ cao để thu được kim loại A và khí B. Tỉ khối của khí B so với hiđro là 20,4. Xác định công thức của oxit kim loại.
2. Đốt hoàn toàn 3,0 gam cacbon trong một bình kín chứa khí oxi. Tính thể tích khí oxi cần thiết (ở điều kiện tiêu chuẩn) để sau phản ứng trong bình có:
a) Một khí duy nhất.
b) Hỗn hợp gồm 2 khí có thể tích bằng nhau.
Các nguyên tố: H = 1; C = 12; O = 16; Mg = 24; Al = 27; S = 32; Cl = 35,5;
Fe = 56; Cu = 64; Zn = 65
2. Đề thi chọn học sinh giỏi môn Hóa học lớp 8 - Đề số 02
Câu 1. (2,0 điểm) Đưa hỗn hợp A bao gồm Mg và Fe vào dung dịch B chứa Cu(NO3)2 và AgNO3. Sau khi lắc đều để phản ứng hoàn tất, ta thu được hỗn hợp rắn C với 3 kim loại khác nhau và dung dịch D chứa 2 muối. Trình bày cách tách riêng từng kim loại ra khỏi hỗn hợp C.
Câu 2. (2,0 điểm) Muối ăn bị lẫn tạp chất như: Na2SO4, NaBr, MgCl2, CaCl2, CaSO4. Mô tả phương pháp tinh chế để thu được muối ăn tinh khiết.
Câu 3. (1,0 điểm) Sử dụng pirit sắt, nước biển, không khí và các thiết bị cần thiết khác. Viết các phương trình hóa học để điều chế các chất: nước Javen, FeSO4, FeCl3.
Câu 4. (2,0 điểm) Đốt hoàn toàn 3,0 gam cacbon trong một bình kín chứa khí oxi. Tính thể tích khí oxi cần thiết (ở điều kiện tiêu chuẩn) để sau phản ứng trong bình còn lại:
a) Một loại khí duy nhất.
b) Hỗn hợp gồm 2 khí có thể tích bằng nhau.
Câu 5. (1,0 điểm) Có 7 lọ chứa các dung dịch riêng biệt: NH4Cl, Zn(NO3)2, (NH4)2SO4, phenolphtalein, K2SO4, HCl, và NaCl không có nhãn. Sử dụng dung dịch Ba(OH)2 làm thuốc thử, xác định được bao nhiêu chất trong số các dung dịch đã cho? Viết phương trình hóa học của các phản ứng để minh họa.
Câu 6. (2,0 điểm) Mô tả hiện tượng và viết các phương trình hóa học cho các thí nghiệm sau:
1. Thêm Na vào dung dịch CuSO4.
2. Nhỏ từ từ dung dịch KOH vào dung dịch AlCl3 đến dư.
3. Thêm bột Cu vào dung dịch FeCl3.
4. Nhỏ từ từ dung dịch HCl vào dung dịch K2CO3 cho đến khi dư và khuấy đều.
Câu 7. (3,0 điểm) Đưa m1 gam hỗn hợp bột Mg và Fe vào 300 ml dung dịch AgNO3 0,8M, khuấy đều để phản ứng hoàn toàn. Sau phản ứng, thu được dung dịch A1 và chất rắn A2 có khối lượng 29,28 g với 2 kim loại. Hòa tan hoàn toàn chất rắn A2 trong dung dịch H2SO4 đặc và đun nóng.
- Tính thể tích khí SO2 (ở điều kiện tiêu chuẩn) được sinh ra.
- Thêm lượng dư dung dịch NaOH vào A1, lọc và rửa kết tủa tạo thành. Nung kết tủa trong không khí ở nhiệt độ cao đến khối lượng không đổi, thu được 6,4 g chất rắn.
Tính tỷ lệ phần trăm theo khối lượng của từng kim loại trong hỗn hợp Mg và Fe ban đầu.
Câu 8. (2,0 điểm) Cần đốt bao nhiêu gam cacbon để khí CO2 sinh ra từ phản ứng tác dụng với 3,4 lít dung dịch NaOH 0,5M sẽ tạo ra hai loại muối, với nồng độ mol của muối hidrocacbonat bằng 1,4 lần nồng độ mol của muối cacbonat trung hòa?
Câu 9. (3,0 điểm) Hòa tan 34,2 gam hỗn hợp gồm Al2O3 và Fe2O3 vào 1 lít dung dịch HCl 2M, sau phản ứng còn dư 25% lượng axit. Cho dung dịch thu được tác dụng với dung dịch NaOH 1M để đạt kết tủa tối thiểu.
a. Tính khối lượng của từng oxit trong hỗn hợp.
b. Tính thể tích dung dịch NaOH 1M đã sử dụng.
Câu 10. (1,0 điểm)
a) Mô tả hiện tượng và giải thích thí nghiệm sau: Dùng muỗng sắt cầm mẫu photpho đỏ, đốt cháy trên ngọn lửa đèn cồn, sau đó nhanh chóng đưa vào bình chứa khí oxi. Khi phản ứng hoàn tất, thêm một ít nước và giấy quỳ tím vào lọ thủy tinh rồi lắc nhẹ.
b) Xem hình vẽ dưới đây:
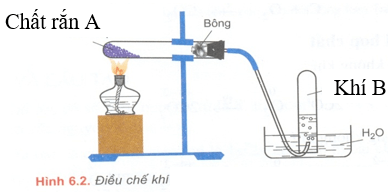
- Đây là sơ đồ để điều chế khí gì? Đưa ra một ví dụ về chất phù hợp với A và viết phương trình hóa học của phản ứng xảy ra.
- Giải thích lý do cần đặt một ít bông ở đầu ống nghiệm. Tại sao ống nghiệm đặt ngang trên giá thí nghiệm cần có miệng ống hơi nghiêng xuống? Và tại sao cần rút ống dẫn khí ra khỏi ống nghiệm trước khi tắt đèn cồn?
c) Sử dụng các phương pháp hóa học để phân biệt các loại bột sau: vôi sống, magie oxit, điphotpho pentaoxit, và natri oxit.
Bài viết trên của Mytour hy vọng đã cung cấp thông tin hữu ích giúp bạn nâng cao kiến thức về Hóa học lớp 8 và giải quyết tốt các bài tập liên quan. Mytour xin chân thành cảm ơn bạn đã đọc!
