Trong hóa học, hợp chất bão hòa là những chất không tham gia vào các phản ứng cộng như hydro hóa, oxy hóa thêm hay liên kết với bazơ Lewis. Thuật ngữ này được áp dụng cho nhiều loại hợp chất hóa học và thường biểu thị các hợp chất ít phản ứng hơn so với các hợp chất không bão hòa. Từ 'saturation' có nguồn gốc từ từ saturare trong tiếng Latin, có nghĩa là 'lấp đầy'.
Hóa học hữu cơ
Các hợp chất không no có khả năng thực hiện những phản ứng cộng mà các hợp chất no như ankan không thể thực hiện. Một hợp chất hữu cơ no chỉ chứa các liên kết đơn giữa các nguyên tử cacbon, với ankan là một ví dụ điển hình. Nhiều hợp chất bão hòa có thể có nhóm chức như rượu.
| Các hợp chất bão hòa | |
| Ethane | Propane |
| 1-Octanol | |
| Axit béo bão hòa | |
Các hợp chất hữu cơ không no
Khái niệm về độ bão hòa có thể được mô tả thông qua các hệ thống đặt tên, công thức và các phép thử phân tích khác nhau. Ví dụ, danh pháp IUPAC là hệ thống quy tắc đặt tên giúp xác định loại và vị trí của các liên kết không bão hòa trong hợp chất hữu cơ. 'Mức độ không bão hòa' là công thức tổng quát để xác định lượng hydro mà hợp chất có thể liên kết. Độ không bão hòa có thể được xác định bằng NMR, khối phổ và phổ IR, hoặc thông qua số brom hoặc số iốt của hợp chất.
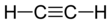
| Các hợp chất không bão hòa | |
|---|---|
|
Etylen |
Axetylen |
|
Axit linoleic | |
Axit béo
Thuật ngữ bão hòa và không bão hòa thường dùng để chỉ các thành phần axit béo trong chất béo. Triglyceride (chất béo) chứa mỡ động vật gồm axit stearic bão hòa và axit oleic không bão hòa đơn. Nhiều loại dầu thực vật chứa axit béo với một (không bão hòa đơn) hoặc nhiều liên kết đôi (không bão hòa đa) trong cấu trúc của chúng.
Các hợp chất bão hòa và không bão hòa trong các lĩnh vực khác ngoài hóa học hữu cơ
Hóa học phối trí
Trong hóa học phối trí, các phức chất không bão hòa có ít hơn 18 điện tử hóa trị, khiến chúng dễ bị cộng oxy hóa hoặc kết hợp với một phối tử bổ sung. Tính không bão hòa thường thấy ở nhiều chất xúc tác. Ngược lại với không bão hòa phối trí là bão hòa phối trí, và các phức chất bão hòa phối trí hiếm khi thể hiện tính chất xúc tác.
Bề mặt
Trong hóa lý, khi nói về các quá trình bề mặt, độ bão hòa biểu thị mức độ chiếm giữ hoàn toàn của các vị trí liên kết. Ví dụ, độ bão hòa bazơ chỉ phần cation có thể trao đổi là các cation bazơ.
