1. Cân bằng phương trình phản ứng
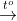
2. Điều kiện để phản ứng xảy ra
Phản ứng xảy ra khi hỗn hợp được đun nóng.
3. Phương pháp thực hiện phản ứng
Đun nóng muối (NH4)2SO4 kết hợp với NaOH.
4. Quan sát hiện tượng để nhận diện phản ứng
Khí không màu, có mùi khai thoát ra.
5. Bài tập áp dụng liên quan
Câu 1: Hiện tượng quan sát được khi đun nóng muối (NH4)2SO4 với NaOH là gì?
A. Khí màu nâu đỏ bay ra.
B. Khí có mùi trứng thối thoát ra.
C. Khí màu vàng lục với mùi xốc phát ra.
D. Khí có mùi khai thoát ra.
Hướng dẫn giải chi tiết
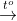
NH3 là khí có mùi khai đặc trưng.
Lựa chọn đúng là D.
Câu 2: Nếu cho dung dịch NaOH dư vào 100 ml dung dịch (NH4)2SO4 1M và đun nhẹ, thể tích khí thu được ở điều kiện chuẩn là bao nhiêu?
A. 1,12 lít. B. 2,24 lít. C. 3,36 lít. D. 4,48 lít
Đáp án: D. Thể tích khí thu được ở điều kiện chuẩn là 4,48 lít.
Câu 3: Làm thế nào để xác định một dung dịch NaOH có phải là dung dịch natri hydroxide không?
Hướng dẫn giải chi tiết:
Có nhiều cách để xác định dung dịch có chứa Natri hydroxide (NaOH) hay không. Dưới đây là các phương pháp phổ biến:
- Sử dụng giấy pH: Giấy pH có thể giúp kiểm tra dung dịch. NaOH là một bazơ mạnh; nếu giấy pH chuyển sang màu xanh đậm hoặc cho giá trị pH cao (thường trên 12), thì dung dịch có thể chứa NaOH.
- Kiểm tra khả năng trung hòa: NaOH là bazơ mạnh, nếu thêm axit vào dung dịch và thấy pH tăng nhanh, thì NaOH đã phản ứng và trung hòa axit.
- Quan sát hiện tượng tạo bọt: Khi thêm axit như axit acetic vào dung dịch NaOH, có thể thấy hiện tượng tạo bọt do khí hydro được giải phóng, làm nổi lên bề mặt nước.
- Sử dụng chất chỉ thị: Thêm vài giọt phenolphthalein vào dung dịch NaOH; nếu nước chuyển sang màu hồng, đó là dấu hiệu cho thấy sự hiện diện của NaOH.
- Kiểm tra khả năng dẫn điện: Dung dịch NaOH có khả năng dẫn điện tốt nhờ vào các ion OH- tự do. Nếu dung dịch có thể dẫn điện, đây có thể là dấu hiệu của sự hiện diện của NaOH.
Sử dụng nhiều phương pháp khác nhau sẽ giúp xác định chính xác hơn sự hiện diện của Natri hydroxide.
Câu 4: Mô tả cách NaOH tương tác với axit và viết phương trình hóa học của phản ứng này.
Hướng dẫn chi tiết:
NaOH (Natri hydroxide) là một bazơ mạnh, và khi phản ứng với axit, nó sẽ trung hòa axit để tạo thành muối và nước. Dưới đây là mô tả và phương trình hóa học cho phản ứng này:
Khi NaOH tiếp xúc với axit, các ion hydroxide (OH-) từ NaOH sẽ phản ứng với ion hydroxonium (H₃O⁺) từ axit. Phản ứng này sẽ trung hòa các ion, sinh ra nước và muối.
Câu 5: Vì sao NaOH thường được dùng để làm sạch ống cống?
Giải đáp chi tiết:
Natri hydroxide (NaOH) là lựa chọn phổ biến để làm sạch ống cống nhờ khả năng phân hủy chất béo và tạo môi trường kiềm, giúp loại bỏ cặn bẩn, chất béo, và tạp chất khác. Dưới đây là những lý do NaOH được ưa chuộng trong việc làm sạch ống cống:
- Tính Bazơ Mạnh: NaOH là một bazơ mạnh, giúp tăng độ kiềm của dung dịch, từ đó làm phân hủy chất béo và cặn hữu cơ, giúp chúng dễ dàng hòa tan trong nước.
- Tác Dụng Hóa Học: NaOH có khả năng phản ứng hóa học với chất béo và cặn bẩn, chủ yếu qua quá trình xà phòng hóa. NaOH phản ứng với chất béo, tạo ra xà phòng và làm cho chúng dễ dàng bị rửa sạch bằng nước.
- Phản Ứng Hóa Học Tạo Bọt: Trong quá trình xử lý, NaOH có thể giải phóng khí hydro (H₂) từ chất béo, tạo ra hiện tượng tạo bọt. Bọt giúp NaOH lan tỏa và đẩy cặn bẩn, chất béo ra khỏi ống cống.
- Loại Bỏ Tắc Nghẽn: NaOH cũng có thể được sử dụng để xử lý tắc nghẽn gây ra bởi chất béo, tảo và các loại cặn khác. Tính chất phân hủy và tạo bọt của nó giúp làm mềm và loại bỏ các tắc nghẽn hiệu quả.
- An Toàn và Hiệu Quả: Natri hydroxide là một chất tẩy rửa mạnh mẽ, nhưng có thể sử dụng an toàn khi tuân thủ đúng hướng dẫn. Nó mang lại hiệu quả cao trong việc làm sạch ống cống mà không cần đến các chất tẩy rửa hóa học mạnh hơn.
Tuy nhiên, cần phải cẩn thận khi sử dụng NaOH và tuân thủ các biện pháp an toàn để tránh ảnh hưởng tiêu cực đến môi trường và sức khỏe con người.
Câu 6: Đề cập một nguy cơ khi làm việc với NaOH.
Lời giải chi tiết:
Khi làm việc với Natri hydroxide (NaOH), có thể gặp một số nguy cơ đối với sức khỏe và môi trường. Dưới đây là một nguy cơ phổ biến khi sử dụng NaOH:
- Nguy Cơ Hóa Học:
+ Ảnh Hưởng Đến Da và Mắt: NaOH là một chất ăn mòn mạnh, có thể gây bỏng rát và tổn thương da nếu tiếp xúc trực tiếp. Nếu NaOH dính vào mắt, nó có thể gây tổn thương nghiêm trọng hoặc thậm chí làm mù mắt.
+ Tương Tác Với Các Chất Khác: NaOH có thể phản ứng mạnh mẽ khi tiếp xúc với các chất khác, nhất là với axit mạnh. Việc xử lý và lưu trữ không đúng cách có thể gây ra các tai nạn hóa học nghiêm trọng.
- Các Biện Pháp Bảo Vệ:
+ Sử Dụng Đồ Bảo Hộ: Khi làm việc với NaOH, nên đeo kính bảo hộ, găng tay chống hóa chất và trang phục bảo hộ để bảo vệ da và mắt khỏi sự tiếp xúc trực tiếp.
+ Làm Việc Trong Điều Kiện Thoáng Mát: Cần làm việc trong môi trường thông gió tốt để giảm nguy cơ hít phải NaOH và hạn chế việc hóa chất bay hơi.
+ Tuân Thủ Quy Định An Toàn: Những người làm việc với NaOH cần được đào tạo về cách sử dụng, lưu trữ và xử lý an toàn. Đồng thời, phải tuân thủ các quy định và biện pháp an toàn hóa chất.
+ Cung Cấp Cơ Sở Hạ Tầng Đúng Cách: Đảm bảo sử dụng các thiết bị bảo vệ cần thiết như bồn chứa an toàn và hệ thống thoát nước chất thải để giảm nguy cơ tai nạn và bảo vệ môi trường.
Câu 7: Thêm dung dịch NH3 đến dư vào 200 ml dung dịch Al2(SO4)3. Lọc lấy chất kết tủa và cho vào 100 ml dung dịch KOH 2M thì kết tủa sẽ tan hết. Tính nồng độ mol của dung dịch Al2(SO4)3 đã sử dụng.
A. 1M
B. 0,25M
C. 0,5M
D. 0,75M
Đáp án là C
Phương trình phản ứng hóa học xảy ra như sau:
6NH3 + Al2(SO4)3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4 (1)
NaOH + Al(OH)3 → NaAlO2 + H2O (2)
Dựa vào phương trình, ta có:
Số mol của Al(OH)3 = Số mol của NaOH = 0,02 × 2 = 0,04 mol
→ Số mol của Al2(SO4)3 = 1/2 × Số mol của Al(OH)3 = 0,02 mol
→ Nồng độ mol của Al2(SO4)3 = 0,02 / 0,04 = 0,5 M
Câu 8: Để phân biệt các muối NH4Cl, NaNO3 và (NH4)2SO4, ta có thể sử dụng hóa chất nào sau đây?
A. HCl.
B. Ba(OH)2.
C. NaOH.
D. AgNO3.
Đáp án đúng là B
Để nhận diện các hóa chất trên, có thể sử dụng Ba(OH)2 như sau:
+ Xuất hiện khí có mùi khai và kết tủa trắng → (NH4)2SO4
(NH4)2SO4 + Ba(OH)2 → BaSO4 ↓ trắng + 2NH3 ↑ mùi khai + 2H2O
+ Xuất hiện khí có mùi khai → NH4Cl
2NH4Cl + Ba(OH)2 → BaCl2 + NH3 ↑ mùi khai + H2O
+ Không có hiện tượng xảy ra → NaNO3
Câu 9: Được cho các dung dịch sau: NH4Cl, Na2SO4, Ba(HCO3)2. Hóa chất nào dưới đây có thể được sử dụng để phân biệt các dung dịch này?
A. Dung dịch KCl.
B. Dung dịch NaOH.
C. Dung dịch C2H5OH
D. Dung dịch Ca(OH)2.
Đáp án là B
Sử dụng NaOH để nhận diện hỗn hợp dung dịch này
Lấy mẫu thử và đánh số thứ tự như sau
Nếu có mùi khai, ống nghiệm đó chứa NH4Cl
NH4Cl kết hợp với NaOH tạo ra NH3, H2O và NaCl
Nếu thấy kết tủa trắng, chất ban đầu là Ba(HCO3)2
Phản ứng: Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + 2H2O
Nếu không có hiện tượng gì, chất là Na2SO4.
Bài viết từ Mytour mong rằng đã cung cấp thông tin hữu ích về phản ứng hóa học: (NH4)2SO4 + NaOH → Na2SO4 + NH3 + H2O.
