1. Cân bằng phương trình hóa học là gì?
Phương trình hóa học được sử dụng để mô tả một phản ứng hóa học. Dựa trên định luật bảo toàn khối lượng, số nguyên tử của mỗi nguyên tố trước và sau phản ứng phải bằng nhau. Để phương trình hóa học được cân bằng, ta phải đảm bảo số lượng các chất phản ứng và sản phẩm, cũng như tỷ lệ nguyên tử và phân tử giữa các chất được đồng nhất.
2. Các tính chất vật lý và hóa học của Mg
2.1. Tính chất vật lý
- Magiê là một kim loại có độ cứng vừa phải, sáng bạc và nhẹ.
- Magiê có mật độ là 1,737 g/cm³, điểm nóng chảy là 648°C và điểm sôi là 1090°C.
2.2. Tính chất hóa học
- Magiê là một chất khử mạnh mẽ.
Mg → Mg²⁺ + 2e⁻
- Phản ứng với phi kim: Do magiê có phản ứng mạnh với oxy, ví dụ: 2Mg + CO₂ → MgO. Do đó, không nên dùng carbon dioxide để dập tắt lửa magiê.
- Phản ứng với axit:
+ Khi tiếp xúc với dung dịch HCl và H₂SO₄ loãng:
Mg + H₂SO₄ → MgSO₄ + H₂
+ Khi phản ứng với dung dịch HNO₃:
4Mg + 10HNO₃ → 4Mg(NO₃)₂ + NH₄NO₃ + 3H₂O
+ Khi tiếp xúc với nước:
Ở nhiệt độ bình thường, magiê gần như không phản ứng với nước. Tuy nhiên, khi nước nóng, magiê phản ứng chậm và tạo thành hydroxit magiê khó tan.
Mg + 2H₂O → Mg(OH)₂ + H₂
3. Hướng dẫn cân bằng phương trình hóa học
Mg + HNO₃ → Mg(NO₃)₂ + N₂O + H₂O
Mg₀ - 2e → Mg²⁺ (x 4)
2N⁵⁺ + 8e → 2N¹⁺ (x 1)
=> Phương trình hóa học cân bằng: 4Mg + 10HNO₃ → 4Mg(NO₃)₂ + N₂O + 5H₂O
4. Phương pháp cân bằng electron trong phản ứng oxi hóa khử
- Bước 1: Xác định số oxi hóa của các nguyên tố để nhận diện chất oxi hóa và chất khử.
- Bước 2: Viết riêng biệt quá trình oxi hóa và quá trình khử, sau đó cân bằng từng quá trình.
- Bước 3: Tìm số lượng electron cần thiết cho chất oxi hóa và chất khử sao cho số electron mà chất khử nhường ra bằng số electron mà chất oxi hóa nhận.
- Bước 4: Đặt các hệ số của chất oxi hóa và chất khử vào phương trình phản ứng, tính toán các hệ số của các chất khác, kiểm tra sự cân bằng của các nguyên tử trong cả hai vế, và hoàn thiện phương trình hóa học.
5. Các bài tập ứng dụng
Bài 1: Cân bằng các phương trình oxi hóa - khử bằng phương pháp cân bằng electron dưới đây:
a) Phản ứng giữa MnO2 và dung dịch axit HCI đặc, sản phẩm là MnCI2, CI2 và H2O.
b) Phản ứng giữa Cu và dung dịch axit HNO3 đặc, nóng, tạo ra Cu(NO3)2, NO2, và H2O.
c) Phản ứng giữa Mg và dung dịch axit H2SO4 đặc, nóng, sinh ra MgSO4, S và H2O.
Giải chi tiết:
a) Phương trình phản ứng hóa học là:
MnO2 + HCI → MnCI2 + CI2 + H2O
- Thực hiện cân bằng phương trình hóa học theo phương pháp cân bằng electron.
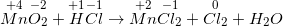
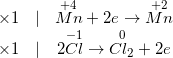
- Phương trình phản ứng đã được cân bằng như sau:
MnO2 + 4HCl → MnCl2 + Cl2 + 2 H2O
b) Phương trình hóa học là:
Cu + HNO3 nóng, đặc → Cu(NO3)2 + NO2 + H2O
- Cân bằng phương trình bằng phương pháp electron:
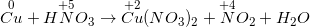
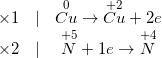
- Phương trình phản ứng đã được cân bằng như sau:
Cu + 4HNO3 nóng, đặc → Cu(NO3)2 + 2NO2 + 2H2O
c) Đưa ra phương trình hóa học:
Mg + H2SO4 nóng, đặc → MgSO4 + S + H2O
- Phương trình hóa học đã được cân bằng như sau:
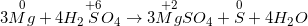
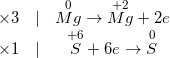
Bài 2: Xét phản ứng: FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + H2O. Xác định hệ số cân bằng của FeSO4 và K2Cr2O7 lần lượt là bao nhiêu?
A. 5; 2
B. 6; 2
C. 6; 1
D. 8; 3
Giải:
Câu 3: Xét phản ứng: Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH
Xác định tỉ lệ hệ số của chất khử và chất oxi hóa sau khi cân bằng là gì?
A. 4:3
B. 3:4
C. 3:2
D. 2:3
Giải thích:
.png)
Câu 5: Biết rằng 4g thủy ngân (Hg) phản ứng với clo để tạo ra 5,42g thủy ngân clorua. Xác định công thức hóa học đơn giản của thủy ngân clorua. Biết Hg = 200.
Giải thích:
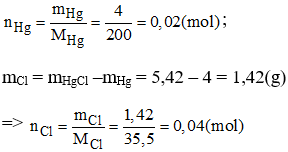
Vậy 0,02 mol thủy ngân (Hg) kết hợp với 0,04 mol clo (Cl).
Suy ra rằng 1 mol thủy ngân (Hg) kết hợp với 2 mol clo (Cl).
→ Công thức hóa học của thủy ngân clorua là: HgCl2
Câu 6: Vẽ sơ đồ nguyên tử và xác định số phân tử của mỗi chất trong các phương trình sau:
a) Na + O2 → Na2O
b) P2O5 + H2O → H3PO4
c) HgO → Hg + O2
d) Fe(OH)3 -> Fe2O3 + H2O
Giải đáp:
a) 4Na + O2 -> 2Na2O
Tỷ lệ nguyên tố Na : nguyên tố O2 : số phân tử Na2O = 4 : 1 : 2
b) P2O5 + 3H2O -> 2H3PO4
Tỷ lệ giữa P2O5, H2O và H3PO4 lần lượt là 1 : 3 : 2
c) 2HgO -> 2Hg + O2
Tỷ lệ nguyên tố HgO, nguyên tử Hg và phân tử O2 là 2 : 2 : 1
d) 2Fe(OH)3 -> Fe2O3 + 3H2O
Tỷ lệ giữa phân tử Fe(OH)3, Fe2O3 và số phân tử H2O là 2 : 1 : 3
Câu 7: Nguyên tử được cấu tạo từ bao nhiêu loại hạt cơ bản?
A. 1
B. 2
C. 3
D. 4
Câu 8. So sánh khối lượng của electron với khối lượng của hạt nhân nguyên tử, nhận định nào là chính xác?
A. Khối lượng của electron chỉ khoảng 1/1840 khối lượng của hạt nhân nguyên tử
B. Khối lượng của electron nhỏ hơn rất nhiều so với khối lượng của hạt nhân nguyên tử
C. Trong tính toán khối lượng nguyên tử, khối lượng của electron thường bị bỏ qua
D. Cả B và C đều đúng.
Câu 9. Tổng số hạt proton, nơtron, electron trong hai nguyên tử kim loại A và B là 142. Trong đó, số hạt mang điện vượt số hạt không mang điện là 42. Số hạt mang điện của nguyên tử B nhiều hơn của nguyên tử A là 12. Xác định các kim loại A và B.
Giải chi tiết:
Gọi tổng số hạt proton, nơtron và electron của hai nguyên tử A và B là 142. Do đó:
pA + nA + eA + pB + nB + eB = 142 -> 2pA + 2pB + nA + nB = 142 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 42. Do đó:
pA + eA + pB + eB - nA - nB = 42 -> 2pA + 2pB - nA - nB = 42 (2)
Số hạt mang điện của nguyên tử B vượt nguyên tử A là 12, do đó:
pB + eB - pA - eA = 12 -> 2pB - 2pA = 12 -> pB - pA = 6 (3)
Từ (1), (2), (3) suy ra: pA = 20 (Ca) và pB = 26 (Fe).
Câu 10: Oxit B có công thức M2O và tổng số hạt cơ bản là 92. Trong oxit, số hạt mang điện vượt số hạt không mang điện là 28. M là gì?
A. Fe
B. Na
C. Al
D. Mg
Câu 11: Hợp chất M2X có tổng số hạt cơ bản là 140. Trong hợp chất này, số hạt mang điện nhiều hơn số hạt không mang điện là 44. Số hạt mang điện của M vượt X là 22. Xác định số hiệu nguyên tử của M và X.
A. 16 và 19
B. 19 và 16
C. 43 và 49
D. 40 và 52
Câu 12: Tổng số proton, electron và neutron của hai nguyên tử A và B là 142. Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 42. Số hạt mang điện của B nhiều hơn A là 12. Xác định số hiệu nguyên tử của A và B.
A. 17 và 19
B. 20 và 26
C. 43 và 49
D. 40 và 52
Câu 13. Tổng số proton, electron và neutron của hai nguyên tử A và B là 188. Trong số đó, số hạt mang điện nhiều hơn số hạt không mang điện là 47. Số hạt mang điện của B nhiều hơn A là 12. Xác định nguyên tử A và B.
A. Cu và K
B. Fe và Zn
C. Mg và Al
D. Ca và Na
Câu 14: Một hợp chất bao gồm các ion M+ và X2-. Trong phân tử M2X2, tổng số proton, neutron và electron là 164. Số hạt mang điện nhiều hơn số hạt không mang điện là 52. Số khối của M cao hơn số khối của X là 23 đơn vị. Tổng số electron của M+ vượt hơn X2- là 7 hạt.
a. Xác định nguyên tố M và X, sau đó viết công thức phân tử của hợp chất M2X2
b. Ghi cấu hình electron của nguyên tố X, cả dạng chữ và dạng obitan.
Hướng dẫn giải:
a. Tìm các nguyên tố M và X, rồi viết công thức phân tử của hợp chất M2X2.
Công thức phân tử của hợp chất là K2O2
b. Cấu hình electron và phân bố electron trong obitan của nguyên tử oxy là: 1s2 2s2 2p4
