1. Phương trình CuO + CO → Cu + CO2
Phương trình phản ứng hóa học: CuO + CO → Cu + CO2
Hiện tượng nhận diện phản ứng: Bột CuO màu đen chuyển thành màu đỏ gạch, đó là Cu.
Điều kiện cần thiết cho phản ứng: Nhiệt độ cao
Tính chất hóa học:
- Mang đầy đủ các tính chất của một oxit bazơ
- Dễ dàng bị khử thành đồng kim loại
+ Phản ứng với axit:
CuO + 2HCl → CuCl2 + H2O
CuO + 2HNO3 → Cu(NO3)2 + H2O
+ Phản ứng với oxit axit
3CuO + P2O5 → Cu3(PO4)2
+ Phản ứng với các chất khử mạnh: H2, C, CO,.....
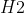
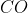
Cách thực hiện phản ứng: Đưa khí CO đi qua bột CuO màu đen
Bạn có biết: Ở nhiệt độ cao, CO có khả năng khử nhiều oxit kim loại, bao gồm CuO. Các oxit bazơ đứng sau oxit nhôm trong dãy hoạt động hóa học như FeO, FbO,... cũng có thể bị khử.
2. Các thông tin chi tiết liên quan đến phương trình
2.1 Chi tiết về phương trình
- Điều kiện cần thiết để phản ứng giữa CO và CuO
+ Nhiệt độ: từ 250 đến 450 độ C
- Quy trình phản ứng CO + CuO: thực hiện bằng cách thổi khí CO qua CuO. Lưu ý: Ở nhiệt độ cao, CO có khả năng khử nhiều oxit kim loại, bao gồm CuO.
- Hiện tượng quan sát sau phản ứng CO + CuO: khí CO2 được giải phóng.
2.2 Chi tiết về các chất tham gia phản ứng
- Thông tin về CO (cacbon monoxit)
+ Màu sắc: Không màu, không có mùi
+ Trạng thái: Dạng khí
+ Khối lượng nguyên tử: 28.0101
Cacbon monoxit, với công thức hóa học CO, là một loại khí không màu, không mùi, dễ cháy và rất độc. Đây là sản phẩm chính của quá trình cháy không hoàn chỉnh của cacbon và các hợp chất chứa cacbon. Cacbon monoxit có nhiều nguồn gốc khác nhau, trong đó khí thải từ động cơ đốt trong sau khi đốt nhiên liệu là một nguồn quan trọng.
- Thông tin về CuO (đồng (II) oxit)
+ Khối lượng nguyên tử: 79.5454
+ Màu sắc: Bột màu đen
+ Trạng thái: Chất rắn dạng bột
Trong ngành công nghiệp thủy tinh, đồng (III) oxit được sử dụng như một chất tạo màu cho vật liệu. Trong điều kiện oxy hóa bình thường, CuO không bị khử thành Cu2O và tạo ra màu xanh lá cho men (màu xanh trong). Các oxit chì có hàm lượng cao sẽ tạo màu xanh đậm hơn, trong khi các oxit kiềm thổ hoặc boron sẽ tạo ra màu sắc khác.
2.3 Thông tin chi tiết về các sản phẩm sau phản ứng
- Thông tin về Cu (đồng)
+ Khối lượng nguyên tử: 6460
+ Màu sắc: Ánh kim đỏ cam
+ Tình trạng: Chất rắn
Đồng là vật liệu có tính dẻo, dễ tạo hình và uốn cong, đồng thời dẫn điện và dẫn nhiệt rất tốt. Do đó, nó được ứng dụng rộng rãi trong sản xuất dây điện, que hàn đồng, tay nắm, và các vật dụng khác trong xây dựng. Đồng cũng được dùng để đúc tượng, chẳng hạn như tượng Nữ thần Tự Do với khối lượng lên tới 81,3 tấn (179.200 pound).
- Thông tin về CO2 (Cacbon dioxit)
+ Khối lượng nguyên tử: 44.0095
+ Màu sắc: Không màu, không mùi
+ Tình trạng: khí
Cacbon dioxit được ứng dụng rộng rãi trong ngành thực phẩm, dầu mỏ, và hóa chất. Một trong những ứng dụng quan trọng nhất của nó là trong sản xuất nước giải khát có gas, nơi nó tạo ra sự sủi bọt cho đồ uống.
3. Phương pháp cân bằng phương trình hóa học CuO + CO → Cu + CO2
Để cân bằng phương trình phản ứng giữa đồng(II) oxit (CuO) và cacbon monoxide (CO) tạo ra đồng (Cu) và cacbon dioxit (CO2), cần điều chỉnh các hệ số trước các chất tham gia sao cho số nguyên tử của mỗi nguyên tố bên trái và bên phải biểu thức phản ứng phải bằng nhau. Dưới đây là cách thực hiện việc cân bằng phương trình này.
Phương trình ban đầu: CuO + CO → Cu + CO2 đã được cân bằng sẵn, vì số lượng nguyên tử mỗi nguyên tố bên trái và bên phải của phản ứng đã bằng nhau.
Phương trình này mô tả sự phản ứng giữa đồng(II) oxit (CuO) và cacbon monoxide (CO) để tạo ra đồng (Cu) và cacbon dioxit (CO2), đồng thời tuân theo nguyên tắc bảo toàn nguyên tố và nguyên tử.
4. Một số ví dụ minh họa
Ví dụ 1: Đưa khí CO dư qua hỗn hợp các oxit CuO, Fe2O3, Al2O3, MgO được nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn thu được là gì?
A. Cu, Fe, Al2O3, MgO
B. Cu, Fe, Al, Mg
C. Cu, Fe, Al, MgO
D. Cu, FeO, Al2O3, MgO
Đáp án A
Giải thích: CuO và Fe2O3 bị khử bởi CO tạo thành các kim loại Cu, Fe và H2O, trong khi Al2O3 và MgO không bị khử bởi H2.
Bài 2: Khi cho khí CO dư qua 9,1 gam hỗn hợp CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Tính khối lượng CuO có trong hỗn hợp ban đầu.
A. 0,8 gam
B. 2,0 gam
C. 8,3 gam
D. 4,0 gam
Đáp án đúng là D
Hướng dẫn giải chi tiết:
Gọi số mol của CuO là x
CuO + CO → Cu + CO2
x mol CuO tương ứng với x mol CO và sinh ra x mol Cu và x mol CO2
Áp dụng nguyên tắc bảo toàn khối lượng trong bài toán
Khối lượng hỗn hợp oxit cộng với khối lượng CO bằng khối lượng chất rắn cộng với khối lượng CO2
Khối lượng hỗn hợp oxit cộng với khối lượng CO bằng khối lượng chất rắn cộng với khối lượng CO2
9,1 + 28x = 8,3 + 44x ⇒ x = 0,05 mol ⇒ khối lượng CuO = 0,05 × 80 = 4 gam
Bài 3: Khi khử 16 gam hỗn hợp oxit kim loại gồm FeO, Fe2O3, Fe3O4, CuO và PbO bằng khí CO ở nhiệt độ cao, khối lượng chất rắn thu được là 11,2 gam. Tính thể tích khí CO đã phản ứng (đktc)
A. 3,36 lít
B. 2,24 lít
C. 4,48 lít
D. 6,72 lít
Đáp án chính xác là D
Hướng dẫn giải:
Áp dụng định luật bảo toàn khối lượng
Số mol CO2 bằng số mol CO là x mol
Khối lượng oxit cộng với khối lượng CO bằng khối lượng chất rắn cộng với khối lượng CO2
28x - 44x = 11,2 - 16 ⇒ x = 0,3
Do đó, thể tích CO là 0,3 × 22,4 = 6,72 lít
Bài 4: Hỗn hợp X bao gồm CuO và ZnO với tỷ lệ mol 1:1 phản ứng với 2,4 gam carbon tạo thành hỗn hợp khí Y. Khi dẫn toàn bộ khí Y qua nước vôi trong, thu được 10 gam kết tủa. Tính phần trăm khối lượng của CuO trong hỗn hợp.
Hướng dẫn giải:
Hỗn hợp khí Y gồm CO và CO2
Số mol C là 0,2 mol; số mol CO2 bằng số mol kết tủa là 0,1 mol
Áp dụng bảo toàn nguyên tố C: số mol CO = số mol C - số mol CO2 = 0,1 mol
Gọi số mol của CuO và ZnO đều là x mol
Áp dụng nguyên tắc bảo toàn electron, ta có:
2x + 2x = 0,1 × 2 + 0,1 × 4
⇒ x = 0,15 mol
⇒ khối lượng CuO = 0,15 × 80 = 12 gam; khối lượng ZnO = 0,15 × 81 = 12,15 gam
Bài 5: Cho khí CO dư đi qua 56 gam hỗn hợp X gồm CuO và MgO nung nóng đến khi phản ứng hoàn toàn, thu được 49,6 gam chất rắn. Tính khối lượng CuO có trong hỗn hợp X.
Hướng dẫn giải:
Khi cho CO dư qua hỗn hợp X, chỉ CuO bị khử
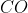 CuOOchất rắn giảm
CuOOchất rắn giảm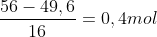
⇒ mCuO = 0,4 x 64 = 16 gam
5. Bài tập thực hành
Câu 1: Đưa khí CO qua ống sứ chứa m gam hỗn hợp X gồm Fe và FexOy, sau khi nung nóng. Khi phản ứng hoàn tất, thu được 64 gam chất rắn Y và 11,2 lít khí với tỉ khối so với hydro là 20,4. Tính giá trị của m?
Câu 2: Đưa khí CO (dư) qua ống sứ chứa 5,36 gam hỗn hợp (nung nóng), thu được m gam chất rắn và hỗn hợp khí X. Khi cho X vào dung dịch dư, thu được 9 gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Tính giá trị của m.
6. Một số phương trình phản ứng hóa học khác của Đồng (Cu) và hợp chất của nó
CuO + 2HCl → CuCl2 + H2O
CuO + H2SO4 → CuSO4 + H2O
CuO + H2 → Cu + H2O
3CuO + 2Al → 3Cu + Al2O3
CuO + C → Cu + CO2
CuO + H2 → Cu + H2O
3CuO + 2NH3 → 3Cu + N2 + 3H2O
CuO + CH3OH → Cu + HCHO + H2O
CuO + C2H5OH → Cu + CH3CHO + H2O
Phương trình phân hủy nhiệt: 2Cu(NO3)2 → 2CuO + 4NO2 + O2
Bài viết của Mytour cung cấp thông tin về phản ứng hóa học và cách cân bằng phương trình CuO + CO → Cu + CO2. Hy vọng bạn sẽ tìm thấy thông tin này hữu ích và có thể áp dụng tốt kiến thức vào các bài tập.
