1. Phương trình phản ứng hóa học
Cl2 + 2KOH → KCl + KClO + H2O
Khi phản ứng giữa clo và kali hidroxit, chúng ta thu được Kali clorua, Kali hypoclorit và nước.
2. Điều kiện phản ứng
Nhiệt độ bình thường
3. Phương pháp thực hiện phản ứng
Cho khí Cl2 vào ống nghiệm chứa dung dịch KOH và đun nóng với giấy quỳ tím
4. Các hiện tượng nhận diện sau phản ứng
Ban đầu, giấy quỳ tím có màu xanh, nhưng sau khi phản ứng xảy ra, giấy quỳ tím sẽ mất màu
5. Đặc điểm của Cl2
* Tính chất vật lý: Clo là khí màu vàng, có mùi xốc và độc, nặng hơn không khí.
* Tính chất hóa học
- Phản ứng với kim loại và nhiệt độ cao để tạo ra muối clorua:
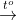
- Phản ứng với phi kim: Cần có nhiệt độ và ánh sáng để phản ứng xảy ra
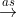
- Phản ứng với nước và dung dịch kiềm: Cl2 vừa là chất oxi hóa, vừa là chất khử trong phản ứng
+ Phản ứng với nước: Khi Cl2 hòa tan trong nước, một phần Cl2 phản ứng theo phương trình: Cl2 + H2O → HCl + HClO
+ Tác dụng với bazơ
+ Tác dụng với muối của các halogen khác
+ Tác dụng với các chất khử khác
+ Phản ứng thế, phản ứng cộng, phản ứng phân hủy với một số hợp chất hữu cơ
6. Đặc điểm của KOH
* Tính chất vật lý: KOH là một chất rắn màu trắng, hút ẩm và dễ tan trong nước
* Tính chất hóa học:
KOH là một bazơ mạnh, có khả năng làm đổi màu giấy quỳ tím
- Phản ứng với oxit axit: Phản ứng xảy ra ở nhiệt độ phòng theo phương trình KOH + SO2 → K2SO3 + H2O
- Phản ứng với axit:
+ Tác dụng với axit tạo ra muối và nước
+ Tác dụng với axit hữu cơ để tạo muối và thủy phân este, peptit
- Tác dụng với kim loại: KOH phản ứng với kim loại mạnh tạo ra bazơ mới và kim loại mới
- Tác dụng với muối: KOH phản ứng với muối để tạo ra muối mới và axit mới
- Tính điện li mạnh: KOH là một bazơ mạnh, phân ly hoàn toàn thành ion K+ và OH- trong nước
- Tác dụng với một số hợp chất lưỡng tính như: Al(OH)3, Al2O3,...
BÀI TẬP LUYỆN
Bài 1: Thực hiện các thí nghiệm sau đây:
(a) Cho khí Cl2 vào dung dịch NaOH ở nhiệt độ phòng
(b) Hấp thu toàn bộ 2 mol CO2 vào dung dịch chứa 3 mol NaOH
(c) Thêm KMnO4 vào dung dịch HCl dư
(d) Đưa hỗn hợp Fe3O4 vào dung dịch HCl dư
(e) Đổ CuO vào dung dịch HNO3
(f) Thêm KHS vào dung dịch NaOH vừa đủ
Số thí nghiệm tạo ra hai muối là:
A. 4 thí nghiệm
B. 5 thí nghiệm
C. 3 thí nghiệm
D. 1 thí nghiệm
Đáp án chính xác là B, 5 thí nghiệm, cụ thể các thí nghiệm tạo ra 2 muối là:
(a) Cho khí Cl2 vào dung dịch NaOH ở nhiệt độ thường, thu được muối NaCl và NaClO
(b) Hấp thu hoàn toàn 2 mol CO2 vào dung dịch chứa 3 mol NaOH, tạo ra muối Na2CO3 và NaHCO3
(c) Thêm KMnO4 vào dung dịch HCl dư, thu được muối MnCl2 và KCl
(d) Đưa hỗn hợp Fe3O4 vào dung dịch HCl dư, tạo ra muối FeCl3 và FeCl2
(f) Thêm KHS vào dung dịch NaOH vừa đủ, thu được muối Na2S và K2S
Bài 2: KOH không phản ứng với khí nào dưới đây?
A. SO2
B. CO2
C. Cl2
D. O2
Đáp án: Chọn đáp án D. O2, KOH không phản ứng với O2.
Bài 3: Chất nào dưới đây có khả năng tẩy màu?
A. KCl
B. NaCl
C. KClO
D. MgCl2
Đáp án: Chọn C. KClO có khả năng tẩy màu.
Bài 4: Để phân biệt 3 dung dịch KOH, HCl, H2SO4 loãng bằng một thuốc thử, thì thuốc thử đó là gì?
Đáp án:
Sử dụng giấy quỳ tím để nhận biết dung dịch KOH
- Sử dụng Zn, Al không thể xác định được
- Sử dụng BaCO3:
+ Thêm vào dung dịch KOH không xảy ra phản ứng
+ Thả vào dung dịch HCl có khí thoát ra
+ Đưa vào dung dịch H2SO4: có khí thoát ra và xuất hiện kết tủa trắng
BaCO3 + 2HCl → BaCl2 + CO2 (khí) + H2O
BaCO2 + H2SO4 → BaSO4 + CO2 (khí) + H2O
Bài 5: Cho a lít dung dịch KOH có pH = 12 và 8 lít dung dịch HCl có pH = 3, thu được dung dịch Y có pH = 11. Giá trị của a là:
Đáp án:
Ta có: a lít dung dịch KOH có pH = 12 → pOH = 2
⇒ nOH - bđ = 0,01a (mol)
8 lít dung dịch HCl có pH = 3 ⇒ bđ = 8 × 10⁻³ (mol)
pH sau = 11 > 7 ⇒ KOH còn dư
Ta có: pOH sau = 3 ⇒ OHdư = 10⁻³ M
⇒ nOH - dư = 0,01a - 8 × 10⁻³ = 10⁻³ × (a + 8) ⇒ a = 1,78
Bài 6: Chỉ sử dụng dung dịch KOH để phân biệt các chất trong nhóm dưới đây?
Đáp án:
- Khi sử dụng KOH:
+ Mg, Fe không có phản ứng gì
+ K, Na chất rắn bị hòa tan và sinh khí (M + H2O → MOH + 0,5 H2)
+ Al2O3: chất rắn hòa tan (Al2O3 + 2NaOH → 2NaAlO2 + H2O)
+ Al: chất rắn hòa tan và sinh khí (Al + NaOH + H2O → NaAlO2 + 1,5 H2)
+ Zn: chất rắn hòa tan và sinh khí (Zn + 2NaOH + H2O → Na2ZnO2 + 2H2)
Bài 7: Cho 150ml dung dịch KOH 1,2M tác dụng với 100ml dung dịch AlCl3 nồng độ x mol/l, thu được dung dịch Y và 4,68 gam kết tủa. Sau khi loại bỏ kết tủa, thêm tiếp 175ml dung dịch KOH 1,2M vào Y, thu được 2,34 gam kết tủa. Xác định giá trị của x:
Lời giải:
AlCl3 + KOH: 0,18 lít → 0,06 mol Al(OH)3 + dung dịch Y
Dung dịch Y + KOH: 0,21 mol → 0,03 mol Al(OH)3
Khi thêm KOH vào dung dịch Y thấy có kết tủa xuất hiện ⇒ dung dịch Y còn dư AlCl3 (0,1x - 0,06) mol. Phản ứng tạo kết tủa xảy ra, 4nAlCl3 dư = nkết tủa + nKOH → nAlCl3 = (0,03 + 0,21) / 4 = 0,06 → x = 1,2.
Bài 8: Hấp thụ hoàn toàn 2,23 lít Cl2 bằng dung dịch NaOH vừa đủ, sau phản ứng thu được dung dịch X, cô cạn dung dịch để lại m gam rắn khan. Xác định giá trị của m:
A. 13,3 gam
B. 6,65 gam
C. 5,85 gam
D. 11,7 gam
Đáp án đúng là A. 6,65 gam. Cách giải: Viết và tính theo phương trình hóa học: 2NaOH + Cl2 → NaCl + NaClO + H2O
Giải chi tiết: nCl2 = 0,1 mol
Phương trình hóa học: 2NaOH + Cl2 → NaCl + NaClO + H2O (0,1 mol)
Chất rắn khan bao gồm: 0,1 mol NaCl và 0,1 mol NaClO => mchất rắn = 0,1 x 58,5 + 0,1 x 74,5 = 13,3 gam
Bài 9: Hấp thụ 2,24 lít Cl2 (điều kiện tiêu chuẩn) vào 250 ml dung dịch NaOH 1M, sau phản ứng thu được dung dịch A. Cô cạn dung dịch A thu được m gam chất rắn khan. Giá trị của m là:
A. 13,35 gam
B. 15,3 gam
C. 5,58 gam
D. 7,5 gam
Đáp án đúng là B. 15,3 gam
Giải chi tiết:
2NaOH + Cl2 → NaCl + NaClO + H2O
0,2 mol - 0,1 mol
Vậy sau phản ứng còn lại 0,1 mol NaCl; 0,1 mol NaCl; 0,1 mol NaCl; 0,05 mol NaOH dư => m = 15,3 gam
Bài 9: Hấp thu V lít khí Cl2 ở điều kiện tiêu chuẩn vào 250ml dung dịch KOH 1M, sau phản ứng thu được dung dịch B. Cô cạn dung dịch B thu được 19,3 gam chất rắn khan, giá trị của V là:
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 5,60 lít
Đáp án: Chọn A. 2,24 lít
Giải chi tiết:
2KOH + Cl2 → KCl + KClO + H2O
Gọi số mol KOH phản ứng là x mol. Sau phản ứng, ta có 0,5x mol KCl, 0,5x mol KClO và (0,25 - x) mol KOH dư.
=> Khối lượng rắn sau phản ứng = 74,5 × 0,5x + 90,5 × 0,5x + 56 × (0,25 - x) = 19,3 gam
=> x = 0,2 mol => nCl2 = 0,1 mol => VCl2 = 2,24 lít
Bài 10: Cho 13,44 lít khí clo (ở điều kiện tiêu chuẩn) đi qua 2,5 lít dung dịch KOH ở 100 độ C. Sau khi phản ứng hoàn toàn, thu được 37,25 gam KCl. Nồng độ của dung dịch KOH là:
A. 0,24 M
B. 0,4 M
C. 0,48 M
D. 0,2 M
Đáp án: Chọn đáp án A. 0,24 M
Giải chi tiết: Sử dụng số mol sản phẩm để tính toán ngược lại số mol chất tham gia, với lượng clo dư sau phản ứng.
Bài viết của Mytour về phản ứng Cl2 + KOH hy vọng sẽ giúp bạn hiểu rõ hơn về phản ứng này và áp dụng tốt cho các bài tập liên quan. Cảm ơn bạn đã đọc bài viết!
