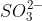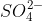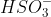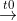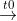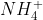Phản ứng ion NH4Cl + NaOH → NH3 + H2O là một loại phản ứng trao đổi đã được cân bằng. Hãy cùng Mytour khám phá chi tiết qua bài viết sau!
1. Cân bằng phương trình: NH4 + NaOH → NH3 + H2O + NaCl
NaOH + NH4Cl → NaCl + NH3 + H2O
- Phương trình ion rút gọn: NH4+ + OH- → NH3 + H2O
- Phương trình hóa học của phản ứng giữa NH4Cl và NaOH: NH4Cl + NaOH → NaCl + NH3 + H2O
- Phản ứng NH4Cl với NaOH có thể diễn ra ngay trong điều kiện bình thường.
- Hiện tượng phản ứng giữa NH4Cl và NaOH: Khí không màu có mùi khai thoát ra.
- Hướng dẫn viết phương trình ion rút gọn của phản ứng giữa NH4Cl và NaOH:
+ Bước 1: Viết phương trình phân tử: NH4Cl + NaOH → NaCl + NH3 + H2O
+ Bước 2: Chuyển các chất dễ tan và điện li mạnh thành ion, giữ nguyên dạng phân tử cho chất kết tủa, chất khí và chất điện ly yếu để thu được phương trình ion đầy đủ: NH4+ + Cl- + Na+ + OH- → Na+ + Cl- + NH3 + H2O
+ Bước 3: Loại bỏ các ion trùng lặp ở hai vế để thu được phương trình ion rút gọn: NH4+ + OH- → NH3 + H2O
2. Các kiến thức quan trọng cần nhớ về NH4+
Muối amoni là chất rắn tinh thể ion, bao gồm cation NH4+ và anion gốc axit.
2.1 Tính chất vật lý của muối amoni
- Tất cả các muối amoni đều dễ tan và hoạt động như những chất điện li mạnh.
(NH4)xA → xNH4+ + Ax-
- Khi muối amoni của axit mạnh (A là gốc axit của một axit mạnh) thì quá trình thủy phân sẽ tạo ra môi trường axit.
NH4+ + H2O ↔ NH3 + H3O+
2.2 Các tính chất hóa học của muối amoni
- Khi muối amoni phản ứng với dung dịch axit, sẽ tạo ra muối mới và bazơ mới.
NH4HCO3 + HCl → NH4Cl + H2O + CO2
- Khi muối amoni phản ứng với dung dịch bazơ, sẽ tạo ra muối mới, NH3 và H2O.
NH4Cl + NaOH → NH3 + H2O + NaCl
- Khi muối amoni phản ứng với dung dịch muối, sẽ tạo ra hai muối mới.
(NH4)2CO3 + CaCl2 → CaCO3 + 2NH4Cl
3
NH4Cl → NH3 + HCl
NH4HCO3 → NH3 + H2O + CO2
- Nếu axit sinh ra có tính oxi hóa mạnh, nó sẽ oxi hóa NH3 để tạo ra các sản phẩm khác.
NH4NO2 → N2 + 2H
NH4NO3 → N2O + 2H2O
2.3 Phương pháp điều chế và nhận diện muối amoni
- Cách điều chế:
+ Kết hợp NH3 với axit.
+ Sử dụng phản ứng trao đổi ion để điều chế.
- Phương pháp nhận diện:
+ Muối amoni sinh khí có mùi khai khi phản ứng với dung dịch kiềm.
+ NH4+ + OH- → NH3 + H2O
3. Bài tập thực hành và áp dụng
Câu 1: Hợp chất X hòa tan trong nước tạo ra dung dịch không màu. Dung dịch này không phản ứng với BaCl2 để tạo kết tủa, nhưng khi tác dụng với NaOH, khí có mùi khai được sinh ra. Khi phản ứng với HCl, khí tạo ra làm đục nước vôi trong và làm mất màu dung dịch thuốc tím. Chất này là
A. NH4HSO3.
B. Na2SO3.
C. NH4HCO3.
D. (NH4)2CO3.
Hướng dẫn giải:
- X phản ứng với NaOH tạo khí có mùi khai, do đó cation là NH4+
→ X chính là NH4HSO3.
Câu 2: Muối NH4HCO3 thuộc loại
A. Muối hỗn tạp.
B. Muối trung hòa.
C. Muối axit.
D. Muối kép.
Hướng dẫn giải:
Đáp án: C
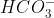
Câu 3: Muối (NH4)2CO3 sẽ không tạo kết tủa khi phản ứng với dung dịch của chất nào sau đây?
A. Ca(OH)2.
B. MgCl2.
C. FeSO4.
D. NaOH.
Hướng dẫn giải:
Đáp án: D
Các phản ứng liên quan là:
(NH4)2CO3 + Ca(OH)2 → CaCO3↓ + 2NH3↑ + 2H2O
(NH4)2CO3 + MgCl2 → MgCO3 + 2NH4Cl
(NH4)2CO3 + FeSO4 → FeCO3↓ + (NH4)2SO4
(NH4)2CO3 + 2NaOH → Na2CO3 + 2NH3↑ + 2H2O
Câu 4: Xét các thí nghiệm dưới đây:
(1). NH4NO2
(2). KMnO4
(3). NH3 + O2
(4). NH4Cl
(5). (NH4)2CO3
(6). AgNO3
Số thí nghiệm dẫn đến sản phẩm là các đơn chất là:
A. 6
B. 5
C. 4
D. 3
Hướng dẫn giải:
Đáp án: C
Câu 5: Muối nào được sử dụng làm bột nở trong thực phẩm?
A. CaCO3.
B. Na2CO3.
C. NH4HCO3.
D. NH4Cl.
Hướng dẫn giải:
Đáp án: C
Người ta sử dụng muối NH4HCO3 làm bột nở trong thực phẩm.
Câu 6: Có ba dung dịch không có nhãn: NaCl, NH4Cl, NaNO3. Dãy hóa chất nào dưới đây có thể giúp phân biệt ba dung dịch này?
A. Phenolphtalein và NaOH.
B. Cu và HCl.
C. Phenolphtalein, Cu và H2SO4 loãng.
D. Quỳ tím và dung dịch AgNO3.
Hướng dẫn giải:
Đáp án D
- Khi thêm AgNO3 vào hai dung dịch còn lại, NaCl sẽ tạo kết tủa trắng.
AgNO3 + NaCl → AgCl↓ + NaNO3
Câu 7: Nhận định nào sau đây là không chính xác về muối amoni?
A. Muối amoni không bền khi gặp nhiệt độ cao.
B. Tất cả các muối amoni đều hòa tan trong nước.
C. Tất cả các muối amoni đều là chất điện ly mạnh.
D. Dung dịch các muối amoni luôn có tính bazơ.
Hướng dẫn giải:
Đáp án D
D là sai vì NH4+ + H2O ⇄ NH3 + H3O+
→ Các muối amoni thường tạo ra môi trường axit.
Câu 8: Đưa từ từ NH3 vào dung dịch CuCl2 400 gam, nồng độ 6,75%.
a. Khi lượng kết tủa đạt cực đại, thể tích NH3 (đktc) sử dụng là bao nhiêu?
b. Khi kết tủa tan hoàn toàn, thể tích NH3 (đktc) sử dụng là bao nhiêu?
Hướng dẫn giải:
nCuCl2 = 400 × 6,75 / 100 × 135 = 0,2 mol
Phương trình phản ứng là:
CuCl2 + 2NH3 + 2H2O → Cu(OH)2↓ + 2NH4Cl (1)
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (2)
a. Khi kết tủa đạt cực đại, chỉ có phản ứng (1) xảy ra
⇒ nNH3 = 0,2 × 2 = 0,4 mol ⇒ VNH3 = 0,4 × 22,4 = 8,96 lít
b. Khi kết tủa hoàn toàn, xảy ra cả phản ứng (1) lẫn phản ứng (2)
nNH3 = 0,2 × 2 + 0,2 × 4 = 1,2 mol ⇒ VNH3 = 1,2 × 22,4 = 26,88 lít
Câu 9: Cho 23,9g hỗn hợp X gồm NH4Cl và (NH4)2SO4 phản ứng hoàn toàn với xút, đun nóng thu được 8,96 lít khí (ở đktc)
a. Tính tỷ lệ khối lượng của từng chất trong hỗn hợp X.
b. Cho 4,78g hỗn hợp X phản ứng với BaCl2 dư. Tính khối lượng kết tủa tạo thành
Hướng dẫn giải:
a. Phương trình phản ứng:
NH4Cl + NaOH → NH3↑ + NaCl + H2O
(NH4)2SO4 + 2NaOH → 2NH3↑ + Na2SO4 + H2O
Ta có hệ phương trình: 53,5x + 132y = 23,9 (1); x + 2y = 0,4 (2)
Từ hệ phương trình 1 và 2, ta tìm được: x = 0,2 và y = 0,1.
%mNH4Cl = 0,2 × 53,5 / 23,9 = 44,77% ⇒ %m(NH4)2SO4 = 55,23%
b. Trong 4,78 gam hỗn hợp X, tính được n(NH4)2SO4 = 0,02 mol
⇒ nBaSO4 = 0,02 × 233 = 4,46 gam
Bài 10: Hỗn hợp A gồm hai muối NH4Cl và NH4NO3 được chia thành hai phần bằng nhau:
Phần 1: Tác dụng với AgNO3 thu được 14,35 gam kết tủa.
Phần 2: Đun nóng với NaOH 0,5M thu được 6,72 lít khí (ở điều kiện chuẩn)
a. Tính tổng khối lượng của hỗn hợp A.
b. Xác định thể tích NaOH cần dùng.
Hướng dẫn giải:
Các phương trình phản ứng:
NH4Cl + AgNO3 → NH4NO3 + AgCl (kết tủa)
NH4Cl + NaOH → NH3 (khí) + NaCl + H2O
NH4NO3 + NaOH → NH3 (khí) + NaNO3 + H2O
nNH4Cl = nAgCl = 14,35 / 143,5 = 0,1 mol
nNH4NO3 = 0,3 - 0,1 = 0,2 mol
a. Khối lượng hỗn hợp A:
mA = 2 × (0,1 × 53,5 + 0,2 × 80) = 21,35 gam
b. Thể tích NaOH cần dùng ở phần 2 là:
V = 0,3 / 0,5 = 0,6 lít
Bài 11: Nhỏ từ từ dung dịch NH3 cho đến dư vào ống nghiệm chứa dung dịch CuSO4. Hiện tượng quan sát được là:
A. Dung dịch chuyển sang màu xanh đậm
B. Xuất hiện kết tủa màu xanh lam
C. Có kết tủa màu xanh lam và khí màu nâu đỏ được giải phóng.
D. Ban đầu xuất hiện kết tủa màu xanh lam, sau đó kết tủa dần tan và chuyển thành dung dịch màu xanh đậm.
Hướng dẫn giải: Đáp án D
Bài 12: Xem xét các nhận định sau về muối amoni:
(1) Tất cả các muối amoni đều hòa tan trong nước;
(2) Các muối amoni là chất điện li mạnh, phân ly hoàn toàn tạo ra ion NH4+ và tạo môi trường bazơ.
(3) Các muối amoni phản ứng với dung dịch kiềm để giải phóng khí amoniac;
(4) Muối amoni không bền khi gặp nhiệt độ cao.
Nhóm các nhận định đúng là:
A. 1, 2, 3 B. 1, 2, 4 C. 1, 3, 4 D. 2, 3, 4
Hướng dẫn giải: Đáp án C
Bài 13: Cho 100 ml dung dịch X chứa Al(NO3)3 0,2M, Cu(NO3)2 0,1M và AgNO3 0,2M phản ứng với dung dịch NH3 dư thu được m gam kết tủa. Giá trị của m là
A. 4,06 B. 1,56 C. 5,04 D. 2,54
Hướng dẫn giải: Đáp án B
Khối lượng kết tủa là: mAl(OH)3 = 0,02 x 78 = 1,56 gam