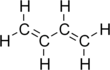
|
| |||
|
| |||
| Names | |||
|---|---|---|---|
| Preferred IUPAC name
Buta-1,3-dien | |||
Other names
| |||
| Identifiers | |||
CAS Number
|
| ||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider |
| ||
| ECHA InfoCard | 100.003.138 | ||
| EC Number | 271-039-0 | ||
| KEGG |
| ||
PubChem <abbr title="<nowiki>Compound ID</nowiki>">CID
|
|||
| RTECS number | EI9275000 | ||
| UNII |
| ||
| UN number | 1010 | ||
CompTox Dashboard (<abbr title="<nowiki>U.S. Environmental Protection Agency</nowiki>">EPA)
|
|||
InChI[hiện]
| |||
SMILES[hiện]
| |||
| Properties | |||
| Công thức hóa học | C4H6 | ||
| Khối lượng mol | 54.0916 g/mol | ||
| Trạng thái | Khí không màu | ||
| Mùi | Mùi dầu hỏa | ||
| Khối lượng riêng |
| ||
| Điểm nóng chảy | −108.9 °C (−164.0 °F; 164.2 K) | ||
| Điểm sôi | −4.4 °C (24.1 °F; 268.8 K) | ||
Độ tan trong nước
|
1.3 g/L at 5 ℃, 735 mg/L at 20 ℃ | ||
| Tan |
| ||
| Áp suất hơi | 2.4 atm (20 °C) | ||
Refractive index (nD)
|
1.4292 | ||
| Độ nhớt | 0.25 cP at 0 °C | ||
| Nguy hại | |||
| Main hazards | Flammable, irritative, carcinogen | ||
| Safety data sheet | See: data page ECSC 0017 | ||
| R-phrases (outdated) | R45 R46 R12 | ||
| S-phrases (outdated) | S45 S53 | ||
| NFPA 704 |
4
3
2 | ||
| Flash point | −85 °C (−121 °F; 188 K) liquid flash point | ||
Autoignition<br><br>temperature
|
420 °C (788 °F; 693 K) | ||
| Explosive limits | 2–12% | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (median dose)
|
548 mg/kg (đường miệng, chuột) | ||
LC50 (median concentration)
|
| ||
LCLo (lowest published)
|
250,000 ppm (rabbit, 30 min) | ||
| US health exposure limits (NIOSH): | |||
PEL (Permissible)
|
TWA 1 ppm ST 5 ppm | ||
REL (Recommended)
|
Potential occupational carcinogen | ||
IDLH (Immediate danger)
|
2000 ppm | ||
| Hợp chất liên quan | |||
Related Alkens
and diens |
Isopren Chloropren | ||
Related compounds
|
Butane | ||
| Supplementary data page | |||
Structure and<br><br>properties
|
Refractive index (n), Dielectric constant (εr), etc. | ||
Thermodynamic
data |
Phase behaviour solid–liquid–gas | ||
Spectral data
|
UV, IR, NMR, MS | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |||
| (what is ?) | |||
| Infobox<span typeof="mw:Entity"> </span>references | |||
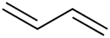
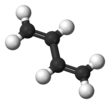
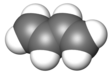
Buta-1,3-dien (hoặc butadien) là một hợp chất hữu cơ với công thức (CH2=CH)2. Đây là một khí không màu, dễ dàng chuyển thành chất lỏng. Butadien đóng vai trò quan trọng trong ngành công nghiệp hóa chất, là monome để sản xuất cao su tổng hợp. Trong phân tử butadien, có hai nhóm vinyl kết hợp với nhau. Đây là dien liên hợp đơn giản nhất.
Dù dễ bị phân hủy nhanh chóng trong khí quyển, butadien vẫn có mặt trong không khí tại các khu vực ngoại thành và ngoại ô do lượng phát thải từ xe cơ giới.
Tên butadien cũng chỉ đồng phân alen 1,2-butadien với cấu trúc H2C=C=CH−CH3. Đồng phân alen này không có ứng dụng công nghiệp.
Lịch sử
Vào năm 1863, nhà hóa học Pháp E. Caventou đã tách butadien từ quá trình nhiệt phân rượu amyl. Chất hydrocarbon này được xác định là butadien vào năm 1886, khi Henry Edward Armstrong phân lập nó từ các sản phẩm nhiệt phân của dầu mỏ. Năm 1910, nhà hóa học Nga Sergei Lebedev đã thực hiện trùng hợp butadien và tạo ra một vật liệu có đặc tính giống cao su. Tuy nhiên, loại polymer này quá mềm để thay thế cao su tự nhiên trong nhiều ứng dụng, đặc biệt là lốp xe.
Ngành công nghiệp butadien bắt đầu phát triển trước Thế chiến II. Nhiều quốc gia chiến tranh nhận thấy rằng trong trường hợp xung đột, họ có thể bị cắt đứt nguồn cung cao su từ các đồn điền do Đế quốc Anh kiểm soát và tìm cách giảm sự phụ thuộc vào cao su tự nhiên. Vào năm 1929, Eduard Tschunker và Walter Bock từ IG Farben ở Đức đã phát minh ra một chất đồng trùng hợp giữa styren và butadien, có thể sử dụng trong sản xuất lốp ô tô. Sản xuất nhanh chóng mở rộng toàn cầu, với butadien được sản xuất từ rượu ngũ cốc ở Liên Xô và Hoa Kỳ, và từ acetylen có nguồn gốc từ than đá ở Đức.
Sản xuất
Cracking hydrocarbon C4
Khử hydro n-butan
Ethanol
2 CH3CH2OH → CH2=CH−CH=CH2 + 2 H2O + H2
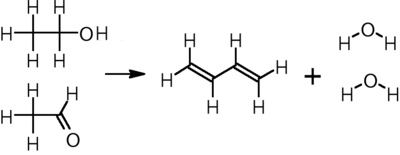
Đi từ buten
Trong môi trường phòng thí nghiệm
Buta-1,3-dien rất khó chế tạo trong phòng thí nghiệm. Các phương pháp đã được tối ưu hóa để sử dụng tiền chất không độc hại. Phản ứng retro-Diels-Alder của cyclohexen hoặc sulfolen là nguồn cung cấp buta-1,3-dien. Sulfolen khi đun nóng sẽ giải phóng dien và lưu huỳnh dioxide
Ứng dụng
Hầu hết butadien được sử dụng trong phản ứng trùng hợp để chế tạo cao su tổng hợp. Polybutadien là một vật liệu mềm mại và có giá thành thấp. Các polymer đồng trùng hợp từ butadien và styren, hoặc butadien và acrylonitril, bao gồm acrylonitrile butadien styren (ABS), acrylonitrile butadien (NBR) và styren-butadien (SBR), là các vật liệu phổ biến nhất cho sản xuất lốp xe.
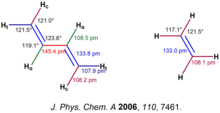
Cấu trúc, hình dạng và độ ổn định
Phản ứng
Phản ứng trùng hợp của butadien được ứng dụng rộng rãi trong ngành công nghiệp. Phản ứng cộng 1,4, ví dụ như phản ứng hydrocyan hóa, minh họa cho xu hướng này. Giống như nhiều dien khác, butadien với xúc tác Pd phản ứng qua phức allyl. Butadien cũng tham gia vào phản ứng Diels-Alder; chẳng hạn, phản ứng với anhydride maleic tạo ra anhydride tetrahydrophthalic.
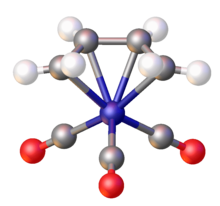
Tương tự các dien khác, butadien là phối tử cho các phức kim loại hóa trị thấp, chẳng hạn như các dẫn xuất Fe(butadien)(CO)3 và Mo(butadien)3.
Sức khỏe và an toàn môi trường
Butadien có độc tính cấp tính thấp. LC50 của nó là 12,5-11,5 vol% khi chuột hít phải.
Tiếp xúc lâu dài với butadien có thể gây ra các vấn đề về tim mạch, bạch cầu và các loại ung thư khác.
- Cyclobutadien
- Polybutadien
- ^ 'Tài liệu đầu tiên'. Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Sách Xanh). Cambridge: The Royal Society of Chemistry. 2014. p. 374. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Hướng dẫn về hóa chất NIOSH. '#0067'. National Institute for Occupational Safety and Health (NIOSH).
- ^ '1,3-Butadiene'. Nồng độ Nguy hiểm Ngay lập tức đối với Sức khỏe và Sự sống (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ “1,3-Butadiene”. Cơ quan Bảo vệ Môi trường Hoa Kỳ EPA. Truy cập ngày 2 tháng 9 năm 2014.
- ^ Caventou, E. (1863). “Về một hợp chất đồng phân của brombutylen hai brom và các dẫn xuất brom của brombutylen”. Justus Liebigs Annalen der Chemie. 127: 93–97. doi:10.1002/jlac.18631270112.
- ^ Armstrong, H. E.; Miller, A. K. (1886). “Phân hủy và hình thành hydrocarbon ở nhiệt độ cao. I. Các sản phẩm từ việc sản xuất khí từ dầu mỏ”. J. Chem. Soc. 49: 74–93. doi:10.1039/CT8864900074.
- ^ Những điều đơn giản không cứu được Trái đất, J. Robert Hunter
- ^ E. B. Hershberg, John R. Ruhoff (1937). “1,3-Butadiene”. Org. Synth. 17: 25. doi:10.15227/orgsyn.017.0025.
- ^ J. Grub, E. Löser (2005), “Butadiene”, Bách khoa toàn thư Ullmann về Hóa chất công nghiệp, Weinheim: Wiley-VCH, doi:10.1002/14356007.a04_431.pub2
- ^ J. E. Nyström, T. Rein, J. E. Bäckvall (1989). “Chức năng hóa 1,4 của 1,3-Dienes qua Palladium-Catalyzed Chloroacetoxylation và Allylic Amination: 1-Acetoxy-4-diethylamino-2-butene và 1-Acetoxy-4-benzylamino-2-butene”. Org. Synth. 67: 105. doi:10.15227/orgsyn.067.0105.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Arthur C. Cope, Elbert C. Herrick (1950). “cis-Δ4-Tetrahydrophthalic Anhydride”. Org. Synth. 50: 93. doi:10.15227/orgsyn.030.0093.
- ^ Reiss, Guido J. (2010). “Định lượng lại (η-s-cis-1,3-butadiene)tricarbonyliron(0)”. Acta Crystallographica Section E. 66 (11): m1369. doi:10.1107/S1600536810039218. PMC 3009352. PMID 21588810.
- ^ “Tờ thông tin NPI”. Lưu trữ ngày 22 tháng 12 năm 2003. Truy cập ngày 10 tháng 1 năm 2006.
Liên kết ngoài
- buta-1,3-dien – Cơ quan Đăng ký Chất độc và Bệnh tật
- buta-1,3-dien – CDC - Hướng dẫn về Hóa chất của NIOSH
- Danh sách ô nhiễm quốc gia – buta-1,3-dien
Hydrocarbon | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hydrocarbon béo bão hòa |
| ||||||||||||||||||||||||
| Hydrocarbon béo không bão hòa |
| ||||||||||||||||||||||||
| Hydrocarbon thơm |
| ||||||||||||||||||||||||
| Khác |
| ||||||||||||||||||||||||
