
| Vật lý vật chất ngưng tụ |
|---|
| Pha · Chuyển pha * QCP |
|
Trạng thái vật chất[hiện] |
|
Hiện ứng pha[hiện] |
|
Pha điện tử[hiện] |
|
Hiệu ứng điện tử[hiện] |
|
Pha từ[hiện] |
|
Giả hạt[hiện] |
|
Vật chất mềm[hiện] |
|
Nhà khoa học[hiện] |
| Cơ học môi trường liên tục | |||
Nguyên lý Bernoulli
| |||
Chất rắn là dạng vật chất khác với chất lỏng (các trạng thái khác gồm chất lỏng, khí và plasma). So với các trạng thái vật chất khác, các phân tử trong chất rắn sắp xếp chặt chẽ hơn và có ít động năng hơn. Chất rắn được đặc trưng bởi độ cứng và khả năng chống lại lực tác dụng lên bề mặt (theo phương vuông góc hoặc phương tiếp tuyến). Những đặc điểm này phụ thuộc vào tính chất của nguyên tử cấu thành, cách sắp xếp cấu trúc, và lực liên kết giữa các nguyên tử. Chất rắn không chảy như chất lỏng để theo hình dạng của vật chứa, cũng không nở ra để lấp đầy thể tích như chất khí. Chất rắn không thể bị nén dễ dàng như chất khí, do các phân tử trong chất khí chuyển động tự do hơn.
Chất rắn thường được phân loại thành ba dạng cơ bản: tinh thể, vô định hình và giả tinh thể. Tinh thể có cấu trúc nguyên tử được sắp xếp theo trật tự đều đặn và tuần hoàn. Hầu hết các kim loại và khoáng chất như muối ăn (natri chloride) đều có cấu trúc tinh thể. Chất rắn vô định hình là những vật chất mà nguyên tử và phân tử không được sắp xếp theo một mạng không gian cụ thể. Thủy tinh, nhựa và gel là những ví dụ điển hình của chất rắn vô định hình. Chất rắn giả tinh thể (hay còn gọi là tựa tinh thể, quasi-crystal) có cấu trúc đối xứng mới, trong đó sự lặp lại của các nguyên tử không tuần hoàn. Cấu trúc tựa tinh thể thường thấy trong các hợp kim của nhôm khi kết hợp với các kim loại như sắt, cobalt hoặc nickel.
Ngành nghiên cứu về chất rắn trong vật lý được gọi là vật lý chất rắn, thuộc nhánh chính của vật lý vật chất ngưng tụ (bao gồm cả chất lỏng). Ngành khoa học vật liệu chủ yếu tập trung vào các tính chất vật lý và hóa học của chất rắn. Ngành hóa học chất rắn đặc biệt chú trọng đến việc tổng hợp các vật liệu mới cũng như nghiên cứu về cấu trúc và thành phần hóa học của chúng.
Cấu trúc vi mô

Các nguyên tử, phân tử hoặc ion trong chất rắn có thể được sắp xếp theo kiểu tuần hoàn đều đặn hoặc không. Những vật liệu có cấu trúc tuần hoàn đều đặn được gọi là tinh thể. Trong một số trường hợp, cấu trúc đều đặn có thể kéo dài liên tục trên quy mô lớn, như trong kim cương, nơi mỗi viên kim cương là một đơn tinh thể. Các vật thể rắn lớn thường không phải là đơn tinh thể mà là sự kết hợp của nhiều đơn tinh thể, gọi là đa tinh thể. Hầu hết kim loại phổ biến và vật liệu gốm là đa tinh thể.
Một số vật liệu khác có cấu trúc nguyên tử không theo một mạng không gian đều đặn. Những chất này được gọi là chất rắn vô định hình; ví dụ như polystyrene, polycacbonat, và thủy tinh.
Cấu trúc của chất rắn, dù là tinh thể hay vô định hình, phụ thuộc vào loại liên kết hóa học, quá trình cơ nhiệt và điều kiện hình thành. Quá trình làm lạnh nhanh giúp giữ dung dịch ở trạng thái vô định hình và ngăn chặn sự hình thành tinh thể, tạo ra chất rắn vô định hình. Ngược lại, làm nguội chậm hoặc ủ nguội sẽ hình thành cấu trúc tinh thể.
Nhiều vật thể thường thấy như nước đá hoặc đồng xu có thành phần hóa học đồng nhất trong toàn bộ cấu trúc của chúng. Tuy nhiên, một số vật liệu khác lại được cấu tạo từ nhiều thành phần khác nhau. Ví dụ, đá là một hỗn hợp của nhiều loại khoáng chất và mineraloid với các thành phần hóa học khác nhau. Các vật liệu hữu cơ tự nhiên như gỗ, tre, v.v. chủ yếu bao gồm các sợi cellulose được nhúng trong một nền lignin hữu cơ. Trong khoa học vật liệu, vật liệu composite được tạo ra từ nhiều loại vật liệu khác nhau để đạt được các tính chất mong muốn.
Phân loại
Sự khác biệt trong cách liên kết giữa các nguyên tử tạo ra các loại chất rắn khác nhau. Có bốn loại liên kết nguyên tử thường gặp trong các tinh thể rắn: liên kết kim loại, liên kết ion, liên kết cộng hóa trị, và liên kết phân tử (lực van der Waals). Ví dụ, tinh thể natri chloride (muối ăn) được tạo thành từ hai ion natri và clo liên kết với nhau bằng liên kết ion. Trong liên kết kim loại, các electron hóa trị di chuyển tự do giữa các nguyên tử kim loại, tạo ra khả năng dẫn điện và dẫn nhiệt cao. Trong cấu trúc kim cương hoặc silicon, các nguyên tử chia sẻ electron và hình thành liên kết cộng hóa trị, tạo ra các tinh thể có độ cứng cao, nhưng một số có thể giòn. Lực Van der Waals, do sự dao động lưỡng cực của điện tích, là lực liên kết yếu, hoạt động trong phạm vi gần (dưới 1 nanomet), giúp liên kết các tinh thể dạng tấm trong cấu trúc graphit hoặc các tấm silicat trong cấu trúc khoáng pyrophyllite. Vì lực van der Waals là yếu, các tinh thể có liên kết này thường có độ cứng thấp và nhiệt độ sôi, nóng chảy thấp. Loại liên kết khác nhau tạo ra các tính chất khác nhau cho các loại chất rắn.
Kim loại

Kim loại thường có khả năng dẫn điện và dẫn nhiệt tốt. Hầu hết các nguyên tố trong bảng tuần hoàn, đặc biệt là những nguyên tố nằm bên trái đường chéo từ bo đến poloni, đều là kim loại. Khi hai hoặc nhiều nguyên tố được kết hợp với nhau trong đó kim loại là thành phần chính, hỗn hợp này được gọi là hợp kim.
Từ thời kỳ tiền sử, con người đã sử dụng kim loại như đồng, bạc, và chì cho nhiều mục đích khác nhau. Độ bền và độ tin cậy của kim loại đã khiến chúng được ưa chuộng trong xây dựng các công trình và cấu trúc, cũng như trong hầu hết các phương tiện giao thông, thiết bị và dụng cụ, đường ống, biển báo giao thông và đường sắt. Sắt và nhôm là hai kim loại kết cấu phổ biến nhất và cũng là những kim loại phong phú nhất trong vỏ Trái Đất. Sắt chủ yếu được sử dụng dưới dạng hợp kim thép, vốn cứng hơn sắt nguyên chất nhờ chứa tới 2,1% cacbon.
Kim loại có khả năng dẫn điện tốt, do đó được ứng dụng rộng rãi trong các thiết bị điện và trong hệ thống truyền tải điện để giảm thiểu hao phí năng lượng. Ví dụ, hệ thống điện gia đình sử dụng dây điện bằng đồng nhờ vào tính dẫn điện tốt và dễ gia công. Với tính dẫn nhiệt cao, kim loại cũng được dùng để sản xuất các dụng cụ nấu ăn.
Nghiên cứu các nguyên tố kim loại và hợp kim của chúng là một phần quan trọng trong các lĩnh vực hóa học chất rắn, vật lý, khoa học vật liệu và kỹ thuật.
Các ion kim loại, với điện tích dương, được liên kết với nhau nhờ vào tập hợp mật độ cao của các electron tự do; lực liên kết này gọi là liên kết kim loại. Trong cấu trúc kim loại, các nguyên tử dễ dàng mất electron ngoài cùng (electron hóa trị), tạo thành các ion dương. Các electron tự do di chuyển khắp mạng lưới của chất rắn, kết hợp với các ion kim loại qua tương tác tĩnh điện giữa các ion và đám mây electron. Số lượng lớn electron tự do trong cấu trúc kim loại làm cho chúng có tính dẫn điện và dẫn nhiệt tốt, đồng thời làm cho kim loại phản chiếu ánh sáng, tạo nên vẻ sáng bóng và rực rỡ.
Các mô hình hiện đại về tính chất kim loại cho thấy ảnh hưởng của các ion dương (tại trung tâm nguyên tử) lên các electron tự do. Do phần lớn kim loại có cấu trúc tinh thể, các ion này thường được sắp xếp theo một mạng lưới không gian tuần hoàn. Về mặt toán học, điện thế của các ion dương này có thể được tính toán bằng nhiều mô hình khác nhau, trong đó mô hình đơn giản nhất là mô hình electron gần như tự do.
Khoáng chất

Khoáng chất là các chất rắn tự nhiên hình thành qua các quá trình địa chất dưới áp suất cao. Chúng có thành phần rất phong phú, từ các nguyên tố và muối đơn giản đến các hợp chất silicat phức tạp với nhiều dạng hình thể khác nhau. Ngược lại, đá là sự kết hợp ngẫu nhiên của nhiều khoáng chất và/hoặc mineraloid mà không có thành phần hóa học cụ thể. Hầu hết các loại đá trong vỏ Trái Đất chứa thạch anh (SiO2), felspat, mica, clorit, cao lanh, calcit, créatinine, olivin, augit, hornblend, magnetit, hematit, limonit và các khoáng chất khác. Một số khoáng chất như thạch anh, mica hay fenspat rất phổ biến, trong khi những khoáng chất khác chỉ xuất hiện tại một số khu vực nhất định trên toàn thế giới. Nhóm khoáng chất lớn nhất là silicat, chiếm phần lớn thành phần của các loại đá (≥95% silicat), chủ yếu bao gồm silic và oxy, với sự bổ sung của các ion nhôm, magiê, sắt, canxi và các kim loại khác.
Gốm sứ

Gốm sứ là các vật liệu vô cơ được cấu thành từ nguyên tố kim loại và phi kim liên kết hóa học với nhau. Chúng có thể tồn tại dưới dạng tinh thể, phi tinh thể, hoặc hỗn hợp của cả hai dạng. Gốm sứ nổi bật với độ cứng cao, khả năng chịu nhiệt tốt, dẫn nhiệt kém và hệ số giãn nở thấp. Đặc biệt, gốm sứ là vật liệu trơ về mặt hóa học, có khả năng chống lại sự ăn mòn hóa học trong môi trường axit hoặc kiềm. Thông thường, gốm sứ có thể chịu được nhiệt độ từ 1000 đến 1600 °C (1800 đến 3000 °F). Tuy nhiên, có một số vật liệu vô cơ không phải oxit như nitrit, borid và cacbit có những đặc tính khác biệt.
Nguyên liệu thô để chế tạo gốm sứ truyền thống bao gồm khoáng sét như kaolinit, silica và felspat. Đất sét, là thành phần chính trong gốm sứ, có công thức Al
2O
3·2SiO
2·2H2O và chứa một lượng nhỏ tạp chất. Silica (SiO2) có nhiệt độ nóng chảy cao, giúp gốm sứ chống lại nhiệt tốt. Felspat (K
2O·Al
2O
3·6H2O) có nhiệt độ nóng chảy thấp, giúp liên kết các cấu tử chịu nhiệt. Các gốm sứ hiện đại còn chứa thêm nhôm oxit (alumin), carbide silic và carbide wolfram, nổi bật với khả năng chống mài mòn và thường được sử dụng trong các ứng dụng như tấm mài mòn trong ngành khai thác.
Phần lớn các vật liệu gốm, chẳng hạn như alumin và các hợp chất của nó, được chế tạo từ bột mịn, tạo thành cấu trúc đa tinh thể với các hạt mịn chứa các trung tâm tán xạ ánh sáng tương đương với bước sóng ánh sáng khả kiến. Do đó, chúng thường không trong suốt, trái ngược với các vật liệu trong suốt. Tuy nhiên, công nghệ nano hiện nay (như sol-gel) đã có thể sản xuất gốm sứ trong suốt đa tinh thể như alumin trong suốt và các hợp chất alumin cho ứng dụng như laser công suất cao. Gốm sứ cao cấp cũng được sử dụng rộng rãi trong y học, điện và điện tử.
Kỹ thuật gốm là lĩnh vực khoa học và công nghệ liên quan đến việc chế tạo các vật liệu, bộ phận và thiết bị bằng gốm ở trạng thái rắn. Quá trình này có thể thực hiện thông qua phản ứng kết tủa từ các dung dịch hóa học dưới tác dụng của nhiệt, hoặc ở nhiệt độ thấp hơn. Thuật ngữ này bao gồm các bước như tinh chế nguyên liệu thô, nghiên cứu và sản xuất các hợp chất hóa học liên quan, hình thành các cấu tử, và nghiên cứu cấu trúc, thành phần cũng như các tính chất của chúng.
Về mặt cơ học, vật liệu gốm thường có đặc tính giòn, rất cứng, chịu nén tốt nhưng kém khả năng chịu lực kéo và cắt. Các vật liệu giòn có thể thể hiện độ bền kéo tốt khi chịu tải trọng tĩnh. Độ bền cho thấy mức năng lượng mà vật liệu có thể hấp thụ trước khi xảy ra hỏng hóc, trong khi độ bền đứt gãy (ký hiệu KIc) thể hiện khả năng của vật liệu chống lại sự đứt gãy khi các vết nứt phát triển. Một vật liệu với giá trị độ bền đứt gãy cao thường có khả năng đứt gãy dẻo hơn. Gãy giòn là đặc điểm chính của hầu hết các vật liệu gốm và gốm thủy tinh, thường có giá trị KIc thấp và không ổn định.
Zirconia, với độ cứng cực cao, được ứng dụng trong sản xuất lưỡi dao và các dụng cụ cắt công nghiệp khác. Các loại vật liệu gốm như nhôm oxit (Al
2O
3), bo carbide (B
4C) và silic carbide (SiC) đã được sử dụng trong áo chống đạn để chịu được lực đạn của súng trường cỡ lớn. Silic nitride (Si
3N
4) được ứng dụng trong các ổ bi sứ nhờ vào độ cứng cao, giúp chống mài mòn hiệu quả. Gốm sứ còn chống hóa chất, làm cho nó phù hợp cho môi trường ẩm ướt mà thép dễ bị ăn mòn do oxy hóa.
Vào đầu những năm 1980, Toyota đã thử nghiệm với động cơ đốt trong gốm có buồng đốt làm bằng gốm. Động cơ gốm không cần hệ thống làm mát, giúp giảm trọng lượng và nâng cao hiệu suất nhiên liệu. Trong động cơ kim loại thông thường, phần lớn năng lượng từ nhiên liệu được tiêu tán dưới dạng nhiệt để ngăn chặn sự nóng chảy của các bộ phận kim loại. Gốm sứ cũng đang được nghiên cứu cho động cơ tuabin khí (Ceramic gas turbine – CGT). Động cơ tuabin làm bằng gốm sứ có thể hoạt động hiệu quả hơn, cho máy bay tầm hoạt động và khả năng chịu tải cao hơn với lượng nhiên liệu nhất định. Tuy nhiên, sản xuất các bộ phận gốm với độ chính xác cao còn gặp khó khăn và tốn kém. Các phương pháp xử lý thường dẫn đến sự phân bố rộng rãi của các sai hỏng mạng tinh thể cực nhỏ, gây ra nhiều vết nứt và hỏng hóc cơ học.
Gốm thủy tinh

Vật liệu gốm thủy tinh kết hợp các đặc điểm của cả thủy tinh vô định hình và gốm tinh thể. Ban đầu được hình thành dưới dạng thủy tinh, chúng sau đó trải qua quá trình kết tinh một phần qua xử lý nhiệt, tạo ra một sự kết hợp hài hòa giữa pha vô định hình và pha tinh thể, với các hạt tinh thể phân bổ đều trên nền thủy tinh vô định hình.
Gốm thủy tinh được sử dụng phổ biến trong sản xuất dụng cụ nấu ăn (trước đây được biết đến với tên Pyroceram và Vision của CorningWare) và mặt bếp, nhờ vào khả năng truyền nhiệt cao, tính chịu nhiệt tốt, không dẫn điện và tính trong suốt. Hệ số giãn nở nhiệt âm của pha tinh thể có thể điều chỉnh để cân bằng với hệ số giãn nở nhiệt dương của pha thủy tinh, giúp gốm thủy tinh duy trì ổn định ở mức khoảng 70% thể tích cấu trúc là pha tinh thể.
Gốm thủy tinh nổi bật với khả năng chịu biến động nhiệt độ mạnh mẽ, ổn định hóa học, dễ gia công cơ khí và chống mài mòn tốt. Ngoài việc được sản xuất, gốm thủy tinh còn có thể hình thành tự nhiên khi sét đánh vào các tinh thể trong cát biển, tạo ra fulgurite—cấu trúc rỗng và phân nhánh được hình thành dưới nhiệt độ cực cao khoảng 2.500 °C.
Chất rắn hữu cơ
Hóa học hữu cơ nghiên cứu các hợp chất chứa carbon và hydro, cùng với các nguyên tố khác như nitơ, oxy, và các halogen như flo, clo, brom và iod. Nghiên cứu này bao gồm phân tích cấu trúc, tính chất, thành phần, phản ứng và các phương pháp điều chế của các hợp chất hữu cơ. Một số hợp chất hữu cơ còn chứa phốt pho hoặc lưu huỳnh. Ví dụ về chất rắn hữu cơ bao gồm gỗ, sáp parafin, naphthalene, cùng nhiều loại polymer và nhựa khác.
Gỗ
Gỗ là một vật liệu hữu cơ tự nhiên, chủ yếu bao gồm các sợi cellulose phân tán đều trong nền lignin. Sợi cellulose trong gỗ có độ bền kéo cao, trong khi lignin—những polymer hữu cơ phức tạp—tăng cường khả năng chịu nén của gỗ. Do đó, gỗ đã được sử dụng làm vật liệu xây dựng quan trọng từ xa xưa, phục vụ cho xây dựng nhà cửa và đóng tàu. Trong ngành xây dựng, gỗ được gọi là gỗ xẻ hoặc gỗ mộc, và không chỉ đóng vai trò là vật liệu kết cấu mà còn được sử dụng để làm khuôn đổ bê tông.
Gỗ cũng được sử dụng rộng rãi trong ngành đóng gói và sản xuất giấy, cả hai đều được làm từ bột giấy. Quá trình sản xuất bột giấy bằng phương pháp hóa học kết hợp nhiệt độ cao với hóa chất kiềm (kraft) hoặc axit (sulfit) để phá vỡ các liên kết hóa học của lignin trước khi tiến hành đốt cháy.
Polymer

Polyme là nhóm hợp chất cao phân tử được hình thành từ các đơn vị cấu trúc lặp lại, liên kết với nhau bằng liên kết cộng hóa trị để tạo thành các chuỗi dài. Khi polyme chỉ bao gồm một loại đơn vị cấu trúc, nó được gọi là polyme đồng thể (homopolymer); còn nếu có từ hai loại đơn vị khác nhau tham gia vào cấu trúc, nó được gọi là polyme đồng trùng hợp (copolymer). Polyetylen là một ví dụ đơn giản của polyme, được tổng hợp từ các phân tử etylen. Có hai loại polyme chính: polyme công nghiệp (nhựa) được sản xuất nhân tạo và polyme sinh học có nguồn gốc tự nhiên.
Các đơn vị cấu trúc lặp đi lặp lại trong polyme gọi là monome. Monome có thể mang nhiều nhóm thế hoặc nhóm chức khác nhau, ảnh hưởng đến tính chất hóa học như khả năng hòa tan và hoạt hóa, cũng như các tính chất vật lý như độ cứng, tỷ trọng, độ bền cơ học, khả năng chống mài mòn, tính chịu nhiệt, độ trong suốt, màu sắc, v.v. Trong protein, sự khác biệt này cho phép polyme hình thành các cấu trúc sinh học hoạt động ưu việt hơn các cấu trúc khác (xem phần tự lắp ráp).

Con người đã sử dụng polyme hữu cơ tự nhiên từ lâu dưới dạng sáp và shellac, thuộc loại polyme nhiệt dẻo. Cellulose, một polyme thực vật, cung cấp độ bền kéo cho sợi tự nhiên và dây thừng. Vào đầu thế kỷ 19, cao su tự nhiên, một polyme hữu cơ tự nhiên, đã được ứng dụng rộng rãi. Polyme là nguyên liệu thô (dưới dạng nhựa dẻo – resin) được dùng để chế tạo nhựa. Nhựa (plastics) là sản phẩm cuối cùng, được tạo ra sau khi thêm một hoặc nhiều polyme hoặc chất phụ gia vào resin và định hình thành sản phẩm cuối cùng. Các polyme phổ biến hiện nay bao gồm polyetylen, polypropylen, polyvinyl chloride, polystyren, nylon, polyeste, acrylic, polyurethane, polycarbonat và silicon. Nhựa thường được phân loại thành nhựa 'hàng hóa', 'đặc thù' và 'kỹ thuật'.
Vật liệu composite


Composite là loại vật liệu đa pha được tạo ra bằng cách kết hợp các vật liệu khác nhau để đạt được các đặc tính mà từng vật liệu thành phần không có. Để được gọi là vật liệu composite, cần đáp ứng ba điều kiện chính: thứ nhất, vật liệu phải được sản xuất nhân tạo (do đó, gỗ và các vật liệu tự nhiên khác không thuộc loại này); thứ hai, vật liệu phải bao gồm nhiều pha với các đặc tính vật lý và hóa học khác nhau, phân cách nhau bằng ranh giới pha; thứ ba, composite phải có các tính chất khác biệt so với từng thành phần riêng lẻ. Hai loại chính của composite là vật liệu nền (matrix) và vật liệu cốt (fiber). Trong quá trình sản xuất, composite còn có thể bao gồm chất liên kết, chất bao phủ, và chất độn. Vật liệu nền gắn kết và phân bố vật liệu cốt, đồng thời truyền tải lực tác động đến vật liệu cốt. Composite có thể được phân loại theo loại vật liệu nền thành ba nhóm: composite nền polyme (PMC), composite nền kim loại (MMC), và composite nền ceramic (CMC).
Vật liệu composite được ứng dụng rộng rãi, từ các vật liệu kết cấu như bê tông cốt thép đến gạch cách nhiệt quan trọng trong hệ thống bảo vệ nhiệt của tàu con thoi NASA. Gạch cách nhiệt, chẳng hạn như Cacbon gia cường–Cacbon (RCC), có khả năng chịu nhiệt lên đến 1510 °C (2750 °F), bảo vệ bề mặt tàu con thoi khỏi sức nóng trong quá trình quay về Trái Đất. RCC là một composite gồm nhiều lớp vải rayon than chì được tẩm nhựa phenolic, sau đó được lưu hóa ở nhiệt độ cao và nhiệt phân để chuyển nhựa thành carbon. Tiếp theo, tấm RCC được ngâm tẩm với cồn furfural trong buồng chân không và nhiệt phân thêm để chuyển cồn furfural thành cacbon. Để tăng khả năng chống oxy hóa và tái sử dụng, các lớp ngoài của RCC được chuyển thành carbide silic.
Các sản phẩm gia dụng làm từ vật liệu composite bao gồm vỏ nhựa của TV, điện thoại di động, và nhiều thiết bị khác. Những vỏ nhựa này thường được làm từ composite nền nhựa nhiệt dẻo như Acrylonitrin butadien styren (ABS), trong đó đã được thêm vào các chất gia cường như đá phấn calci cacbonat, bột talc, sợi thủy tinh hoặc sợi cacbon để cải thiện độ bền, khối lượng hoặc khả năng phân tán tĩnh điện. Những chất phụ gia này thường được gọi là sợi gia cường hoặc chất phân tán, tùy thuộc vào mục đích sử dụng của chúng.
Vật liệu nền trong composite bao quanh và hỗ trợ các vật liệu gia cường (cốt) bằng cách duy trì sự ổn định của chúng. Các vật liệu gia cường cung cấp các tính chất cơ học và vật lý đặc biệt, làm tăng cường khả năng của vật liệu nền. Sự kết hợp này mang lại các thuộc tính vật liệu mới, không có sẵn từ các thành phần riêng lẻ, và sự đa dạng của vật liệu nền và gia cường cho phép các nhà thiết kế lựa chọn công thức phối trộn tốt nhất.
Chất bán dẫn

Chất bán dẫn là các vật liệu có giá trị điện trở suất (và độ dẫn điện) nằm giữa chất dẫn điện kim loại và chất cách điện phi kim loại. Chúng thường được tìm thấy trong bảng tuần hoàn khi di chuyển theo đường chéo từ nguyên tố Bo. Các nguyên tố bên trái là chất dẫn điện (kim loại), trong khi các nguyên tố bên phải là chất cách điện.
Các thiết bị sử dụng vật liệu bán dẫn là cốt lõi của ngành công nghệ điện tử hiện đại, bao gồm radio, máy tính, điện thoại, và nhiều thiết bị khác. Các linh kiện bán dẫn quan trọng bao gồm bóng bán dẫn, pin mặt trời, diod và mạch tích hợp. Tấm quang điện mặt trời là một thiết bị bán dẫn lớn, chuyển đổi trực tiếp ánh sáng thành điện năng.
Trong vật liệu dẫn điện kim loại, dòng điện được dẫn bởi các electron chuyển động, trong khi ở chất bán dẫn, dòng điện có thể được di chuyển bởi electron hoặc các 'lỗ trống' tích điện dương trong cấu trúc dải điện tử. Các chất bán dẫn phổ biến bao gồm silic, germani và gali arsenua.
Vật liệu nano
Nhiều chất rắn truyền thống thay đổi đặc tính khi giảm kích thước xuống nanomet. Ví dụ, các hạt nano vàng và silicon (thường có màu xám) có thể có màu đỏ; hạt nano vàng nóng chảy ở nhiệt độ thấp hơn nhiều (khoảng 300 °C cho kích thước 2,5 nm) so với vàng dạng tấm (1064 °C); và các sợi nano kim loại có độ bền cao hơn nhiều so với kim loại ở dạng khối. Diện tích bề mặt của các hạt nano rất lớn, khiến chúng trở thành đối tượng nghiên cứu quan trọng cho các ứng dụng trong năng lượng. Ví dụ, kim loại bạch kim có thể được sử dụng làm chất xúc tác trong ô tô hoặc pin nhiên liệu màng trao đổi proton (PEM). Ngoài ra, các oxit gốm (hoặc gốm kim loại) của lanthan, xeri, mangan và niken đang được phát triển cho pin nhiên liệu oxit rắn (SOFC). Các hạt nano lithi, lithi-titanat và tantali đang được áp dụng trong pin Li-ion. Các hạt nano silicon đã chứng minh khả năng mở rộng đáng kể dung lượng lưu trữ của pin Li-ion trong chu kỳ giãn nở-co lại. Các sợi nano silicon có thể hoạt động liên tục mà không bị suy giảm và có tiềm năng sử dụng trong pin với thời gian lưu trữ mở rộng đáng kể. Các hạt nano silicon cũng đang được ứng dụng trong các pin năng lượng mặt trời mới, với việc các chấm lượng tử silicon trên nền silicon đa tinh thể tăng sản lượng điện áp lên tới 60% nhờ phát huỳnh quang ánh sáng trước khi tiếp nhận. Diện tích bề mặt lớn của các hạt nano và màng mỏng là yếu tố quan trọng trong việc tối ưu hóa khả năng hấp thụ bức xạ.
Vật liệu sinh học
Nhiều vật liệu tự nhiên (hoặc sinh học) là những tổ hợp phức tạp với các đặc tính cơ học ấn tượng. Những cấu trúc này, hình thành qua hàng trăm triệu năm tiến hóa, đã trở thành nguồn cảm hứng cho các nhà khoa học vật liệu trong việc phát triển các vật liệu mới. Các đặc điểm nổi bật của chúng bao gồm cấu trúc phân cấp, tính đa chức năng và khả năng tự phục hồi. Tính tự tổ chức, hoặc khả năng tự sắp xếp từ cấp độ phân tử trở lên, là một yếu tố quan trọng trong nhiều vật liệu sinh học. Vì vậy, tự sắp xếp (self-assembly) ngày càng trở thành một chiến lược quan trọng trong tổng hợp hóa học các vật liệu sinh học hiệu suất cao.
Tính chất vật lý
Tính chất vật lý của các nguyên tố và hợp chất cung cấp thông tin về thành phần hóa học, bao gồm mùi, màu sắc, thể tích, tỷ trọng (khối lượng trên một đơn vị thể tích), điểm nóng chảy, điểm sôi, nhiệt dung, hình dạng và cấu trúc ở nhiệt độ phòng (rắn, lỏng hoặc khí; tinh thể lập phương, tam giác, v.v.), độ cứng, độ xốp, chỉ số khúc xạ, và nhiều đặc tính khác. Phần này xem xét một số tính chất vật lý của vật liệu ở trạng thái rắn.
Tính chất cơ học

Tính chất cơ học của vật liệu phản ánh các đặc điểm như độ bền và khả năng chống biến dạng của chúng. Ví dụ, dầm thép được sử dụng trong xây dựng nhờ vào độ bền cao, cho phép chúng chịu tải trọng mà không bị gãy hoặc cong vênh đáng kể.
Các tính chất cơ học bao gồm độ đàn hồi và độ dẻo, độ bền kéo, độ bền nén, độ bền cắt, độ bền đứt gãy, độ dẻo (vật liệu giòn có độ dẻo thấp) và độ cứng lõm. Cơ học chất rắn là ngành nghiên cứu hành vi của vật chất rắn dưới ảnh hưởng của các lực bên ngoài và sự thay đổi nhiệt độ.
Chất rắn không chảy như chất lỏng ở cấp độ vĩ mô. Bất kỳ thay đổi nào so với hình dạng ban đầu được gọi là sự biến dạng. Tỷ lệ giữa sự biến dạng và kích thước ban đầu gọi là biến dạng. Nếu ứng suất tác dụng thấp, hầu hết các vật liệu rắn đều phản ứng sao cho biến dạng tỷ lệ thuận với ứng suất (định luật Hooke). Hệ số tỷ trọng này được gọi là môđun đàn hồi hoặc môđun Young. Vùng biến dạng này được gọi là vùng đàn hồi tuyến tính. Ba mô hình có thể mô tả cách một vật rắn phản ứng với ứng suất:
- Tính đàn hồi – Khi ứng suất được loại bỏ, vật liệu trở về trạng thái ban đầu của nó (không bị biến dạng).
- Nhớt đàn hồi – Đây là loại vật liệu có tính đàn hồi nhưng cũng có hiện tượng giảm chấn. Khi ứng suất không còn tác dụng, công thực hiện để chống lại các hiệu ứng giảm biến dạng (do ma sát) được chuyển hóa thành nhiệt trong vật liệu. Điều này tạo ra một vòng lặp trễ trong đồ thị ứng suất–biến dạng, cho thấy phản ứng cơ học có sự phụ thuộc vào thời gian.
- Tính dẻo – Khi ứng suất tác động lên vật liệu có tính đàn hồi nhỏ hơn giá trị giới hạn chảy, vật liệu đó sẽ phản ứng theo tính đàn hồi. Khi ứng suất vượt quá giới hạn chảy, vật liệu trở nên dẻo và không phục hồi được trạng thái ban đầu. Biến dạng dẻo sau điểm giới hạn chảy là không hồi phục và trở nên bền vững cố định.
Nhiều vật liệu trở nên yếu hơn khi nhiệt độ tăng. Những vật liệu giữ được độ bền ở nhiệt độ cao được gọi là vật liệu chịu lửa và được ứng dụng trong nhiều lĩnh vực. Ví dụ, gốm thủy tinh dùng làm mặt bếp nhờ vào đặc tính cơ học tốt và khả năng chịu nhiệt lên đến 1000 °C trong điều kiện thay đổi nhiệt độ nhanh chóng. Trong ngành hàng không vũ trụ, vật liệu hiệu suất cao được sử dụng trong thiết kế ngoại thất máy bay và tàu vũ trụ phải có khả năng chống sốc nhiệt. Do đó, sợi tổng hợp từ polyme hữu cơ và vật liệu composite – composite nền polyme, gốm, hoặc kim loại – cùng với polyme sợi gia cường đang được thiết kế cho mục đích này.
Tính chất nhiệt

Trong chất rắn kết tinh, các nguyên tử hoặc phân tử có vị trí cố định trong mạng không gian và sắp xếp theo trật tự ba chiều, có thể dao động xung quanh vị trí của chúng. Lý thuyết động học chất rắn dựa trên lý thuyết quang phổ của dao động mạng tinh thể trong mạng lưới tinh thể hoặc thủy tinh. Chuyển động này xảy ra ở cấp độ nguyên tử, do đó cần thiết bị chuyên dụng cao như thiết bị quang phổ để quan sát hoặc phát hiện.
Tính chất nhiệt của chất rắn bao gồm khả năng dẫn nhiệt, cho thấy khả năng của vật liệu trong việc truyền nhiệt. Ngoài ra, chất rắn còn có nhiệt dung riêng, tức là khả năng lưu trữ năng lượng dưới dạng nhiệt (hoặc dao động mạng tinh thể nhiệt).
Tính chất điện
Tính chất điện của chất rắn bao gồm độ dẫn điện, điện trở, trở kháng và điện dung. Các chất dẫn điện như kim loại và hợp kim có đặc tính đối lập với chất cách điện như thủy tinh và gốm sứ. Chất bán dẫn nằm giữa hai loại vật liệu này. Đối với kim loại, dòng điện được dẫn qua các electron, trong khi ở chất bán dẫn, cả electron và lỗ trống đều tham gia vào việc tạo ra dòng điện. Các vật liệu dẫn ion cũng góp phần vào việc tạo ra dòng điện.
Nhiều vật liệu cho thấy tính siêu dẫn ở nhiệt độ thấp, bao gồm các nguyên tố kim loại như thiếc và nhôm, các hợp kim kim loại khác nhau, một số chất bán dẫn có tạp chất và một số loại gốm đặc biệt. Điện trở suất của phần lớn kim loại dẫn điện giảm khi nhiệt độ giảm, nhưng không giảm xuống quá thấp. Tuy nhiên, trong chất siêu dẫn, điện trở giảm đột ngột về mức không khi nhiệt độ giảm xuống dưới mức tới hạn. Dòng điện trong vòng dây siêu dẫn có thể duy trì mãi mãi mà không cần nguồn cấp.
Chất điện môi, hay chất cách điện, là vật liệu có khả năng chống lại dòng điện chạy qua. Ví dụ như chất dẻo, chất điện môi có xu hướng tập trung điện trường đặt vào nó, một đặc tính được ứng dụng trong tụ điện. Tụ điện là thiết bị lưu trữ năng lượng trong điện trường giữa hai bản dẫn đặt gần nhau. Khi áp hiệu điện thế vào tụ điện, các điện tích bằng nhau nhưng trái dấu tích tụ trên mỗi bản tụ. Tụ điện được sử dụng trong các mạch điện để lưu trữ năng lượng và trong các bộ lọc điện tử để phân biệt giữa tín hiệu tần số cao và tần số thấp.
Tính chất cơ điện
Áp điện là khả năng của một số vật liệu (dạng tinh thể hoặc gốm) tạo ra điện áp và dòng điện khi chịu tác động cơ học. Ngược lại, khi có hiệu điện thế đặt vào hai đầu tinh thể áp điện, chúng sẽ thay đổi hình dạng. Một số vật liệu polyme như cao su, len, tóc, xơ gỗ và lụa có thể hoạt động như electret (loại vật liệu điện môi). Ví dụ, polyvinylidene fluoride (PVDF) có phản ứng áp điện mạnh mẽ hơn nhiều so với các vật liệu áp điện truyền thống như thạch anh (SiO2). Độ biến dạng (khoảng 0,1%) của nó rất hữu ích trong các ứng dụng kỹ thuật như nguồn điện cao thế, loa phóng thanh, tia laser, cũng như các cảm biến và đầu dò hóa học, sinh học, quang học.
Tính chất quang học
Vật liệu có thể truyền ánh sáng (như thủy tinh) hoặc phản xạ ánh sáng (như kim loại). Ánh sáng có thể xuyên qua vật liệu ở một số bước sóng, trong khi lại bị chặn ở những bước sóng khác. Ví dụ, kính cửa sổ trong suốt đối với ánh sáng nhìn thấy, nhưng lại ngăn ánh sáng tia cực tím. Đặc tính này được ứng dụng trong các bộ lọc quang học hấp thu chọn lọc dựa trên bước sóng của ánh sáng tới.
Tùy vào ứng dụng, vật liệu rắn cần hội tụ cả tính chất quang học và cơ lý. Ví dụ, các cảm biến hồng ngoại ('tầm nhiệt') trên tên lửa được bảo vệ bởi lớp vật liệu trong suốt với bức xạ hồng ngoại. Hiện nay, saphir đơn tinh thể được chọn cho các mái vòm tên lửa dẫn đường hồng ngoại tốc độ cao. Saphir có khả năng truyền ánh sáng trong vùng hồng ngoại trung bình (300 nm–5 µm), nhưng khả năng truyền giảm ở bước sóng lớn hơn khoảng 4,5 µm ở nhiệt độ phòng. Dù saphir bền hơn các vật liệu vòm hồng ngoại tầm trung khác ở nhiệt độ phòng, nhưng nó lại yếu đi ở nhiệt độ trên 600 °C.
Truyền sóng ánh sáng bước sóng qua sợi quang học liên quan đến khả năng truyền dẫn đồng thời của một số loại thủy tinh đặc biệt với mức tổn thất cường độ thấp. Dải tần số này được gọi là ống dẫn sóng quang học phức, nơi hiện tượng nhiễu được giảm thiểu tối đa. Các ống dẫn sóng quang đóng vai trò quan trọng trong các mạch quang tích hợp và hệ thống thông tin quang học.
Quang–điện tử
Pin mặt trời, hay tế bào quang điện (PV cell), là thiết bị chuyển đổi ánh sáng thành điện năng. Cơ bản, thiết bị thực hiện hai chức năng chính: tạo ra các hạt mang điện (electron và lỗ trống) khi hấp thụ ánh sáng, và tách chúng để truyền điện qua một tiếp điểm dẫn điện (electron được di chuyển qua kim loại tiếp xúc với mạch ngoài). Quá trình này gọi là hiệu ứng quang điện, và nghiên cứu liên quan được gọi là quang điện.
Pin mặt trời có rất nhiều ứng dụng. Chúng đã được sử dụng từ lâu trong các khu vực không có điện lưới, như hệ thống điện ở vùng sâu, vệ tinh, tàu thăm dò không gian, máy tính cầm tay, đồng hồ đeo tay, điện thoại vô tuyến và các hệ thống bơm nước. Gần đây, pin mặt trời còn được tích hợp vào các cụm mô-đun năng lượng mặt trời (bảng quang điện) kết nối với lưới điện qua bộ biến tần, không chỉ cung cấp điện chính mà còn bổ sung nguồn điện.
Mọi tế bào năng lượng mặt trời đều cần một vật liệu hấp thụ ánh sáng để tạo ra các điện tử qua hiệu ứng quang điện. Các vật liệu này thường được thiết kế để hấp thụ hiệu quả các bước sóng ánh sáng mặt trời đến Trái Đất. Một số pin mặt trời còn được tối ưu hóa để hấp thụ ánh sáng từ ngoài bầu khí quyển của Trái Đất.
- Chất lỏng
- Chất khí
- Plasma
Liên kết bên ngoài
- Chất rắn (Solid) trên Encyclopædia Britannica (tiếng Anh)
- Chất rắn trong Từ điển bách khoa Việt Nam
- Vật lý chất rắn trong Từ điển bách khoa Việt Nam
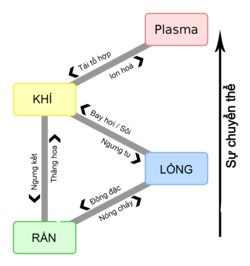
Trạng thái vật chất |
|---|
Băng |
|---|
Các mô hình nguyên tử |
|---|
| Tiêu đề chuẩn |
|
|---|

