1. Benzen là gì? Đặc điểm của benzen
Benzen, một hydrocacbon thơm với công thức phân tử C6H6, là nguyên liệu quan trọng và đa dụng trong ngành công nghiệp hóa chất và sản xuất. Mặc dù ít hòa tan trong nước, benzen dễ dàng hòa tan trong các dầu khoáng, dầu động thực vật và dung môi hữu cơ, tạo điều kiện thuận lợi cho việc tổng hợp nhiều hợp chất hữu cơ khác.
Trong ngành công nghiệp, benzen đóng vai trò thiết yếu trong sản xuất nhiều hợp chất hữu cơ như anilin, clo benzen, nitrobenzen và phenol. Đặc biệt, benzen là dung môi hữu ích để hòa tan chất béo, giúp nâng cao hiệu quả trong sản xuất và chế biến các sản phẩm hóa dầu và hóa chất.
Benzen cũng có vai trò quan trọng trong ngành công nghiệp xăng, nơi các dẫn xuất thơm như toluene và xylene được sử dụng trong chế tạo xăng. Tuy nhiên, do nguy cơ sức khỏe và ung thư, việc sử dụng Benzen đã bị hạn chế nghiêm ngặt. Hiện nay, nồng độ Benzen trong xăng phải duy trì dưới 1% để bảo vệ sức khỏe người tiêu dùng.
Trên toàn cầu và tại Việt Nam, đã có các biện pháp kiểm soát nghiêm ngặt nhằm hạn chế sử dụng Benzen để bảo vệ sức khỏe và môi trường. Tại Việt Nam, quy định số 108 LB/QĐ đã cấm sử dụng Benzen trong ngành công nghiệp, đánh dấu một bước quan trọng trong việc bảo vệ sức khỏe cộng đồng và môi trường.
Đặc điểm vật lý
Benzen là một hợp chất đặc biệt với tính chất nổi bật. Nó xuất hiện dưới dạng dung dịch lỏng trong suốt, không màu, nhưng có mùi giống xăng, khiến nó dễ nhận diện. Tính chất bay hơi nhanh và dễ cháy của Benzen cũng là điểm cần lưu ý.
Khả năng bay hơi nhanh của Benzen có thể tạo ra môi trường nguy hiểm khi tiếp xúc với không khí. Chất này dễ dàng bay vào không khí và có thể gây ra hỗn hợp dễ cháy nổ khi phản ứng với oxy. Vì vậy, việc xử lý, lưu trữ và sử dụng Benzen trong công nghiệp cần tuân thủ quy trình và biện pháp an toàn nghiêm ngặt để bảo vệ con người và môi trường.
Benzen có khả năng hòa tan một lượng nhỏ trong nước, nhưng hoàn toàn hòa tan trong các dung môi hữu cơ khác. Với khối lượng riêng là 0,8786 g/cm3, benzen nhẹ hơn nước và dễ nổi trên mặt nước khi tiếp xúc.
Nhiệt độ nóng chảy và nhiệt độ sôi của Benzen là các chỉ số quan trọng giúp hiểu rõ tính chất của hợp chất này. Benzen nóng chảy ở nhiệt độ thấp, chỉ 5,5 độ C, nên nó tồn tại dưới dạng lỏng ở nhiệt độ phòng, thuận tiện cho việc sử dụng và xử lý trong các ứng dụng công nghiệp và nghiên cứu hóa học.
Ngược lại, nhiệt độ sôi của Benzen là 80,1 độ C, cho thấy Benzen chuyển từ trạng thái lỏng sang hơi ở nhiệt độ này. Tính chất sôi này làm cho Benzen hữu ích trong các quy trình chưng cất và phân tách chất trong ngành công nghiệp và phân tích hóa học.
Các đặc tính đặc biệt và tính độc đáo của Benzen đã tạo nên sự quan trọng của nó trong nhiều lĩnh vực, như sản xuất dược phẩm, công nghiệp hóa chất và nghiên cứu khoa học. Sự linh hoạt và đa dạng của Benzen đã giúp nó đóng vai trò quan trọng trong việc cung cấp sản phẩm và giải pháp cho con người trong cuộc sống hàng ngày và công nghiệp.
Tính chất hóa học
Benzen, nhờ cấu trúc đặc biệt của nó, có những phản ứng hóa học đặc trưng mà ta có thể khám phá. Các phản ứng phổ biến của Benzen bao gồm phản ứng thế, phản ứng cháy và một số phản ứng cộng.
Phản ứng thế:
Benzen có khả năng tham gia vào phản ứng thế, trong đó các nguyên tử hoặc nhóm nguyên tử thay thế một số vị trí trên vòng Benzen. Ví dụ, khi Benzen tiếp xúc với halogen nguyên chất dưới điều kiện nhiệt độ bình thường và có sự xúc tác của sắt, xảy ra phản ứng sau đây:
C6H6 + Br2 → C6H5Br + HBr
Hơn nữa, Benzen cũng có khả năng trải qua phản ứng nitro hoá, chẳng hạn như khi phản ứng với axit nitric đặc, dưới sự xúc tác của nhiệt độ và axit sunfuric đặc:
C6H6 + HO−NO2 → C6H5−NO2 + H2O
Phản ứng cháy:
Giống như các hydrocacbon khác, Benzen cháy trong oxy để tạo ra khí CO2 và hơi nước. Khi Benzen cháy trong không khí, ngoài CO2 và hơi nước, còn có thể sinh ra một ít muội than:
2C6H6 + 15O2 (nhiệt độ) → 12CO2 + 6H2O
Phản ứng cộng:
Benzen không tham gia phản ứng cộng như các hydrocacbon bão hòa khác như etylen và acetylen. Tuy nhiên, dưới tác dụng của nhiệt độ và xúc tác phù hợp, Benzen có thể phản ứng cộng, ví dụ như phản ứng với khí hydro.
C6H6 + 3H2 (nhiệt độ, xúc tác Ni) → C6H12
Những phản ứng này minh chứng cho tính đa dạng và đặc trưng của Benzen trong hóa học, đồng thời có vai trò quan trọng trong các ứng dụng công nghiệp và nghiên cứu hóa học.
2. Các đồng đẳng, đồng phân và danh pháp của Benzen
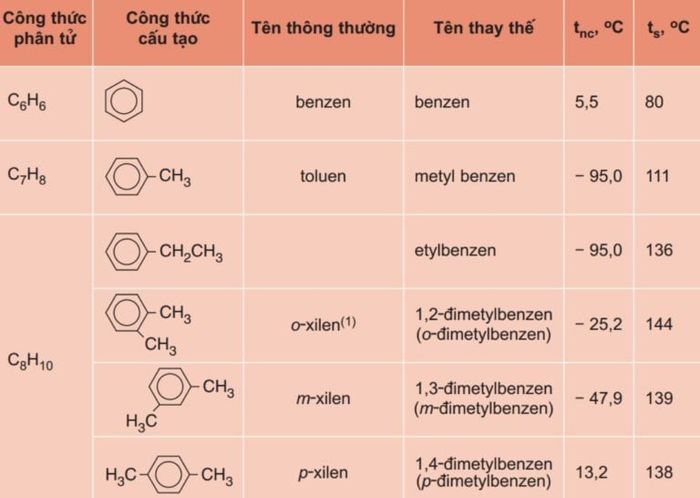
Tương tự như các ankan, anken, ankin, Benzen thuộc nhóm hydrocacbon thơm với đặc điểm chung là dãy đồng đẳng của nó. Tất cả các chất này có công thức phân tử chung CnH2n-6 với n ≥ 6 và cấu trúc mạch vòng, do đó Benzen được gọi là 'vòng Benzen.'
Trong dãy đồng đẳng của Benzen, chỉ riêng Benzen (C6H6) không có đồng phân, còn lại các chất khác đều có ít nhất một đồng phân. Đặc biệt, từ công thức phân tử C8H10 trở đi, có hai loại đồng phân: một loại liên quan đến cấu trúc mạch cacbon và một loại liên quan đến vị trí của các nhóm ankyl quanh vòng Benzen.
Khi đề cập đến các hợp chất này, có thể sử dụng hai loại danh pháp: tên thông thường và tên thay thế.
Tên thông thường được sử dụng rộng rãi, ví dụ như C6H6 gọi là 'Benzen,' C7H8 là 'Toluen,' và C8H10 có thể là 'o-xilen,' 'm-xilen,' hoặc 'p-xilen,' tùy thuộc vào cấu trúc cụ thể.
Tên thay thế thường bắt nguồn từ nhóm ankyl nếu có, sau đó kết hợp với từ 'Benzen.' Ví dụ, nếu có một nhóm ankyl trong cấu trúc, tên thay thế sẽ là 'tên nhóm ankyl' + 'Benzen.'
3. Công thức chung của dãy đồng đẳng Benzen là gì?
A. CnH2n+6 (với n ≥ 6).
B. CnH2n-6 (với n ≥ 3).
C. CnH2n-8 (với n ≥ 8).
D. CnH2n-6 (với n ≥ 6).
4. Cách chế tạo Benzen như thế nào?
Benzen, với các đặc tính độc đáo và ứng dụng đa dạng, giữ vai trò quan trọng trong đời sống hàng ngày. Việc điều chế Benzen từ nhiều nguồn khác nhau đáp ứng nhu cầu trong các lĩnh vực như sản xuất dược phẩm và các hợp chất quan trọng.
Một phương pháp điều chế Benzen là phản ứng axetilen ở nhiệt độ cao, trong đó axetilen (C3CH=CH) chuyển thành Benzen (C6H6). Quá trình này có vai trò quan trọng trong sản xuất Benzen từ các nguồn khác.
Ngoài ra, Benzen cũng có thể được tạo ra từ axit benzoic qua phản ứng với NaOH, tạo ra Benzen cùng với Na2CO3. Đây là một phương pháp phổ biến trong hóa học nguyên liệu.
Benzen không chỉ được chiết xuất từ nhựa than đá qua chưng cất mà còn có thể tách biệt nhờ quy trình này, giúp loại bỏ các thành phần khác của nhựa than đá.
Benzen còn có thể được tổng hợp từ xiclohexan với sự hỗ trợ của chất xúc tác như platina (Pt) và quá trình đun nóng, chuyển đổi xiclohexan thành Benzen và hidro (H2).
Benzen cũng có thể được tạo ra từ n-hexan thông qua xúc tác và nhiệt độ cao, dẫn đến sự chuyển hóa n-hexan thành Benzen và hidro (H2).
Những phương pháp chế biến này không chỉ phục vụ nhu cầu công nghiệp mà còn đóng góp vào sản xuất các sản phẩm quan trọng, cung cấp hợp chất thiết yếu cho cuộc sống hàng ngày.
