1. Hiệu suất là gì?
1.1. Định nghĩa về hiệu suất
Hiệu suất (hay còn gọi là hiệu năng) là khả năng hoạt động hiệu quả và đạt được kết quả dự kiến trong một hoạt động, quá trình hoặc hệ thống. Nó thường được đánh giá bằng cách so sánh giữa kết quả thực tế và kết quả kỳ vọng, hoặc so sánh giữa hiệu quả của các hệ thống khác nhau.
Trong các tình huống khác nhau, khái niệm về hiệu suất có thể được áp dụng cho nhiều khía cạnh. Ví dụ, trong ngành kinh doanh, hiệu suất thường liên quan đến khả năng của một doanh nghiệp hoặc tổ chức để đạt được các mục tiêu và phát triển. Trong lĩnh vực công nghệ, hiệu suất có thể chỉ đến tốc độ, độ chính xác, hoặc hiệu quả của một hệ thống hay thiết bị.
Để đạt được hiệu suất tối ưu, thường cần phải cải thiện việc sử dụng tài nguyên hiện có, giảm thiểu sự lãng phí và hoàn thành mục tiêu một cách nhanh chóng và chính xác. Điều này có thể bao gồm việc cải tiến quy trình làm việc, nâng cao năng suất lao động, áp dụng công nghệ tiên tiến hoặc tối ưu hóa các thuật toán và phương pháp trong hệ thống máy tính.
Đạt được hiệu suất tốt yêu cầu tối ưu hóa việc sử dụng tài nguyên có sẵn, giảm thiểu sự lãng phí và hoàn thành mục tiêu một cách nhanh chóng và chính xác. Điều này có thể liên quan đến việc cải tiến quy trình làm việc, nâng cao năng suất lao động, áp dụng công nghệ tiên tiến hoặc tối ưu hóa các thuật toán và phương pháp trong hệ thống máy tính.
Hiệu suất trong phản ứng hóa học được hiểu như thế nào?
Trong phản ứng hóa học, hiệu suất là thước đo cho mức độ thành công của phản ứng trong việc chuyển đổi các chất đầu vào thành các sản phẩm mong muốn. Hiệu suất phản ứng thường được tính bằng cách so sánh lượng sản phẩm thực tế thu được với lượng sản phẩm lý thuyết dự đoán.
Công thức để tính hiệu suất phản ứng thường được biểu diễn như sau: Hiệu suất (%) = (Sản phẩm thực tế / Sản phẩm lý thuyết) x 100%
Cụ thể là:
- Sản phẩm thực tế là khối lượng hoặc số mol của sản phẩm thực sự thu được trong phản ứng.
- Sản phẩm lý thuyết là khối lượng hoặc số mol của sản phẩm dự đoán theo lý thuyết trong điều kiện lý tưởng.
Hiệu suất phản ứng thường được sử dụng để đánh giá hiệu quả của quy trình hóa học. Một hiệu suất cao cho thấy phản ứng diễn ra hiệu quả và đạt được số lượng sản phẩm dự kiến. Ngược lại, hiệu suất thấp có thể chỉ ra sự mất mát trong quá trình phản ứng, dẫn đến lãng phí tài nguyên và chi phí gia tăng.
Hiệu suất có thể được đánh giá dựa trên nhiều yếu tố khác nhau như hiệu suất chuyển đổi, hiệu suất sản phẩm, hiệu suất tổng hợp, hoặc hiệu suất bền vững, tùy thuộc vào mục tiêu cụ thể của phản ứng hóa học đang được nghiên cứu.
2. Công thức để tính hiệu suất trong phản ứng hóa học
Phần trăm hiệu suất của phản ứng hóa học được tính theo công thức: % hiệu suất = (khối lượng thực tế / khối lượng lý thuyết) x 100%.
Công thức tính hiệu suất là:
H = m(thực tế) / m(lý thuyết) x 100%
Trong công thức trên
H là tỷ lệ hiệu suất phản ứng (%) m(tt) là khối lượng sản phẩm thực tế (g) m(lt) là khối lượng sản phẩm lý thuyết (g) tính theo phương trình hóa học.

=> Để tính độ hao hụt của phản ứng, bạn cần dựa vào phần trăm tính theo công thức sau:
% hao hụt = 100% – % hiệu suất.
*Chú ý: Tính hiệu suất dựa trên số mol của chất thiếu (số mol nhỏ hơn)
Từ công thức cũng có thể tính như sau:
nC = nA phản ứng = (nA ban đầu * H) / 100
Số mol nA ban đầu cần dùng: nA ban đầu = (nC * 100) / H
Những điểm cần lưu ý khi tính hiệu suất phản ứng
Khi tính toán hiệu suất phản ứng, cần lưu ý các điểm sau:
1. Đảm bảo đơn vị chính xác: Khi tính toán hiệu suất, cần phải xác định đúng các đơn vị như gam, mol... để tránh lỗi trong phép tính.
2. Hiệu suất phản ứng không thể vượt quá 100%: Hiệu suất phản ứng phải luôn dưới 100%. Nếu kết quả tính toán vượt quá 100%, điều này có thể chỉ ra rằng sản phẩm không tinh khiết hoặc có yếu tố khác làm tăng hiệu suất không thực tế.
3. Phân biệt hiệu suất với sai số và độ hao hụt: Cần phân biệt rõ giữa hiệu suất phản ứng, sai số và độ hao hụt để đánh giá độ chính xác và hiệu quả của phản ứng.
4. Công thức tính hiệu suất phản ứng: Hiệu suất phản ứng được tính theo công thức: % hiệu suất = (lượng sản phẩm thực tế / lượng sản phẩm lý thuyết) x 100.
5. Độ hao hụt của phản ứng: Độ hao hụt được tính theo công thức: % độ hao hụt = 100% - % hiệu suất.
6. Sai số của phản ứng: Sai số phản ứng được tính bằng công thức: Sai số = lượng sản phẩm lý thuyết - lượng sản phẩm thực tế. Tính toán hiệu suất phản ứng chỉ là một phương pháp đánh giá sơ bộ về hiệu quả của quá trình hóa học, và có thể còn các yếu tố khác như hiệu suất chuyển đổi, hiệu suất tổng hợp tùy theo mục tiêu và phạm vi của phản ứng cụ thể.
Công thức để tính khối lượng chất tham gia khi có hiệu suất: Vì hiệu suất phản ứng không đạt 100%, nên lượng chất tham gia thực tế cần đưa vào phản ứng phải nhiều hơn để bù đắp sự hao hụt. Sau khi tính khối lượng chất tham gia theo phương trình phản ứng, khối lượng cần thiết là: m(lt) = m(tt) * 100 / H
Công thức tính khối lượng sản phẩm khi có hiệu suất
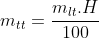
3. Một số bài tập ứng dụng
Bài 1. Đun nóng 0,1 mol CaCO3 thu được 0,08 mol CaO. Tính hiệu suất của phản ứng hóa học xảy ra.
Hướng dẫn giải chi tiết bài tập
Phương pháp 1:
CaCO3 → CaO + CO2
0,1 mol → 0,1 mol
Theo lý thuyết, 0,1 mol CaCO3 sẽ tạo ra 0,1 mol CaO.
Tuy nhiên, thực tế chỉ thu được 0,08 mol CaO.
Do đó, khối lượng lý thuyết của CaO là 0,1 mol (theo lý thuyết), trong khi lượng thực tế thu được là 0,08 mol.
Hiệu suất phản ứng được tính là H(%) = (lượng thực tế/lượng lý thuyết) * 100 = (0,08/0,1) * 100 = 80%,
Phương pháp 2:
CaCO3 → CaO + CO2
0,08 mol ← 0,08 mol
Theo tỉ lệ mol trong phương trình, để tạo ra 0,08 mol CaO cần phải sử dụng 0,08 mol CaCO3.
Tuy nhiên, bài toán yêu cầu sử dụng 0,1 mol CaCO3 để nung.
Tóm lại, đối với CaCO3, lượng tính toán theo phản ứng là 0,08 mol (khối lượng lý thuyết), còn lượng thực tế cần là 0,1 mol.
Hiệu suất phản ứng
H = (lượng lý thuyết / lượng thực tế) * 100 = (0,08 / 0,1) * 100 = 80%
Bài 2: Một loại quặng pirit chứa 95% FeS2. Nếu nhà máy sản xuất 100 tấn H2SO4 98% mỗi ngày, thì cần bao nhiêu quặng pirit? Biết hiệu suất điều chế H2SO4 là 90%.
Sơ đồ phản ứng: FeS2 → H2SO4 = 90% → 2H2SO4
Theo lý thuyết: 120 → 196
Phản ứng: 60 ← 98 tấn
Với hiệu suất điều chế H2SO4 là 90%, ta có mFeS2 thực tế = 60 / 90% = 200/3 tấn
Vì quặng có chứa 95% FeS2, nên mquặng = (200/3) * (100/95) = 70,18 tấn
Bài 3: Cho hỗn hợp A gồm axit formic và axit axetic (tỉ lệ mol 1:1). Lấy 5,3 gam hỗn hợp A phản ứng với 5,75 gam C2H5OH (có xúc tác H2SO4 đặc), thu được hỗn hợp este (hiệu suất phản ứng este hóa là 85%). Tính khối lượng hỗn hợp este thu được.
Theo đề bài, vì số mol ancol nhiều hơn số mol của hai axit nên ancol là dư.
Số mol ancol tham gia phản ứng = 2 * số mol axit = 0,1 mol.
Áp dụng định luật bảo toàn khối lượng ta có:
Khối lượng ancol + khối lượng axit = khối lượng este + khối lượng nước
= 0,1 * 46 + 5,3 = khối lượng este + 0,1 * 18
=> Khối lượng este = 8,10 gam
Do hiệu suất của các phản ứng este hóa là 80%, nên khối lượng este thực tế thu được = 8,10 * 85 / 100 = 6,885 gam.
Trên đây là bài viết về công thức tính hiệu suất phản ứng hóa học một cách chính xác và dễ hiểu.
