
| Nước H 2O | |||
|---|---|---|---|
|
| |||
Phân tử nước với cấu trúc hình học | |||
Một giọt nước rơi trong cốc thủy tinh | |||
| Danh pháp IUPAC | water, oxidane | ||
| Tên khác | Hydrogen hydroxide (HH or HOH), hydrogen oxide, dihydrogen monOxide (DHMO) (systematic name), dihydrogen oxide, hydric acid, hydrohydroxic acid, hydroxic acid, hydrol, μ-oxido dihydrogen, κ-hydroxyl hydrogen(0) | ||
| Nhận dạng | |||
| Số CAS | 7732-18-5 | ||
| PubChem | 962 | ||
| ChEBI | 15377 | ||
| ChEMBL | 1098659 | ||
| Số RTECS | ZC0110000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ | ||
| Tham chiếu Beilstein | 3587155 | ||
| Tham chiếu Gmelin | 117 | ||
| UNII | 059QF0KO0R | ||
| Thuộc tính | |||
| Công thức phân tử | H 2O | ||
| Khối lượng mol | 18.01528(33) g/mol | ||
| Bề ngoài | White crystalline solid, almost colorless liquid with a hint of blue, khí không màu | ||
| Mùi | Không mùi | ||
| Khối lượng riêng | Liquid: 0.9998396 g/mL at 0 °C 0.9970474 g/mL at 25 °C 0.961893 g/mL at 95 °C Solid: 0.9167 g/ml at 0 °C | ||
| Điểm nóng chảy | 0,00 °C (273,15 K; 32,00 °F) | ||
| Điểm sôi | 99,98 °C (373,13 K; 211,96 °F) | ||
| Độ hòa tan trong nước | N/A | ||
| Độ hòa tan | Poorly hòa tan trong haloalkanes, aliphatic và aromatic hydrocarbons, ethers. Improved solubility in carboxylates, alcohols, ketones, amines. Miscible with methanol, ethanol, propanol, isopropanol, acetone, glycerol, 1,4-dioxane, tetrahydrofuran, sulfolane, acetaldehyde, dimethylformamide, dimethoxyethane, dimethyl sulfOxide, acetonitrile. Partially miscible with Diethyl ether, Methyl Ethyl Ketone, Dichloromethane, Ethyl Acetate, Bromine. | ||
| Áp suất hơi | 3,1690 kilôpascal hay 0,031276 atm at 25 °C | ||
| Độ axit (pKa) | 13.995 | ||
| Độ bazơ (pKb) | 13.995 | ||
| Độ dẫn nhiệt | 0.6065 W/(m·K) | ||
| Chiết suất (nD) | 1,3330 (20 °C) | ||
| Độ nhớt | 0.890 cP | ||
| Acid liên hợp | Hydronium | ||
| Base liên hợp | HydrOxide | ||
| Cấu trúc | |||
| Cấu trúc tinh thể | Hexagonal | ||
| Hình dạng phân tử | Bent | ||
| Mômen lưỡng cực | 1.8546 D | ||
| Nhiệt hóa học | |||
| Enthalpy hình thành ΔfH298 | −285.83 ± 0.04 kJ/mol | ||
| Entropy mol tiêu chuẩn S298 | 69.95 ± 0.03 J/(mol·K) | ||
| Nhiệt dung | 75.385 ± 0.05 J/(mol·K) | ||
| Các nguy hiểm | |||
| Nguy hiểm chính | Chết đuối Tuyết lở
(xem thêm Trò lừa dihydro monoxide) | ||
| NFPA 704 |
0
0
0
| ||
| Điểm bắt lửa | Không bắt lửa | ||
| Chỉ dẫn nguy hiểm GHS | H317 | ||
| Các hợp chất liên quan | |||
| Cation khác | Hydrogen sulfide Hydrogen selenide Hydrogen telluride Hydrogen polonide Hydrogen peroxide | ||
| Nhóm chức liên quan | Acetone Methanol | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa).
(cái gì ?)
Tham khảo hộp thông tin | |||
Nước (H
2O) là một hợp chất vô cơ phân cực ở nhiệt độ phòng, không vị và không mùi, gần như không màu với sắc xanh nhẹ. Được mệnh danh là 'dung môi vạn năng' và 'dung môi của sự sống', nước là hợp chất hóa học được nghiên cứu nhiều nhất. Nước là chất phổ biến nhất trên Trái Đất, tồn tại ở cả ba trạng thái: rắn, lỏng, khí. Nó cũng là phân tử phổ biến thứ ba trong vũ trụ (sau hydro phân tử và carbon monoxide).
Các phân tử nước hình thành liên kết hydro mạnh và phân cực cao. Tính phân cực này cho phép nước phân tách các ion muối và liên kết với các chất phân cực khác như rượu và axit, giúp chúng tan rã. Liên kết hydro cũng tạo nên nhiều tính chất độc đáo của nước, chẳng hạn như dạng rắn ít đậm đặc hơn dạng lỏng, điểm sôi cao là 100°C so với khối lượng mol của nó và khả năng tỏa nhiệt lớn.
Nước là chất lưỡng tính, có thể thể hiện tính axit hoặc base tùy thuộc vào độ pH của dung dịch. Nó dễ dàng tạo ra các ion H
và OH
. Liên quan đến tính lưỡng tính, nước trải qua quá trình tự ion hóa, sản phẩm của các nồng độ H
và OH
luôn tỷ lệ nghịch với nhau.
Đặc tính vật lý
Nước là một hợp chất hóa học với công thức H
2O; một phân tử nước gồm hai nguyên tử hydro liên kết cộng hoá trị với một nguyên tử oxy. Nước là chất lỏng không vị, không mùi ở nhiệt độ và áp suất tiêu chuẩn. Nước lỏng hấp thụ yếu ở bước sóng khoảng 750 nm, tạo nên màu xanh lam. Điều này có thể quan sát dễ dàng trong bồn tắm hoặc chậu rửa có lớp lót trắng. Các tinh thể băng lớn, như sông băng, cũng có màu xanh.
Dưới điều kiện tiêu chuẩn, nước chủ yếu tồn tại dưới dạng lỏng, khác với các hydride tương tự thuộc họ oxy thường là khí. Tính chất độc đáo này của nước là do liên kết hydro. Các phân tử nước liên tục chuyển động và các liên kết hydro bị phá vỡ và tái tạo trong thời gian nhanh hơn 200 femto giây. Tuy nhiên, liên kết này đủ mạnh để tạo ra nhiều tính chất đặc biệt của nước, một số làm cho nó không thể thiếu đối với sự sống.
Nước, băng và hơi nước
Trong khí quyển và trên bề mặt Trái Đất, pha lỏng là phổ biến nhất và thường được gọi là 'nước'. Pha rắn của nước là băng, thường có cấu trúc tinh thể cứng hoặc dạng hạt như tuyết. Ngoài băng kết tinh hình lục giác phổ biến, còn có các pha tinh thể và vô định hình khác của băng. Pha khí của nước là hơi nước. Hơi nước và mây có thể nhìn thấy được hình thành từ các giọt nước nhỏ lơ lửng trong không khí.
Nước cũng có thể tồn tại dưới dạng lỏng siêu tới hạn. Nhiệt độ tới hạn là 647 K và áp suất tới hạn là 22.064 MPa. Trong tự nhiên, điều này hiếm khi xảy ra do điều kiện cực kỳ khắc nghiệt. Một ví dụ có thể là ở những phần nóng nhất của miệng phun thủy nhiệt dưới nước sâu, nơi nước được đun nóng đến nhiệt độ tới hạn bởi hoạt động núi lửa và áp suất cực cao gây ra bởi trọng lượng của đại dương ở độ sâu lớn. Áp suất này đạt được ở độ sâu khoảng 2200 mét, thấp hơn nhiều so với độ sâu trung bình của đại dương là 3800 mét.
Nhiệt dung, nhiệt hóa hơi và nhiệt hạch
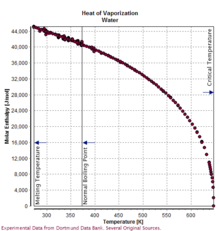
Nước có nhiệt dung riêng rất cao, đạt 4.114 J/(g·K) ở 25°C, chỉ xếp sau amonia trong số các chất dị hợp tử. Nước cũng có nhiệt hóa hơi cao (40,65 kJ/mol hoặc 2257 kJ/kg ở điểm sôi bình thường). Cả hai tính chất này là kết quả của liên kết hydro mạnh giữa các phân tử nước. Nhờ những tính chất đặc biệt này, nước có khả năng điều hòa khí hậu Trái Đất bằng cách giảm thiểu biến động nhiệt độ lớn. Phần lớn năng lượng tăng thêm trong hệ thống khí hậu từ năm 1970 đã được hấp thụ bởi các đại dương.
Entanpi riêng của phản ứng tổng hợp (còn gọi là nhiệt ẩn) của nước là 333,55 kJ/kg ở 0°C. Năng lượng này tương đương với lượng cần để làm tan băng hoặc làm nóng băng từ -160°C đến điểm nóng chảy của nó, hoặc làm nóng cùng lượng nước khoảng 80°C. Trong số các chất thông dụng, chỉ có amonia có entanpi cao hơn. Điều này giúp nước chống lại sự tan chảy của băng trên sông băng và băng trôi. Trước và sau khi có làm lạnh cơ học, nước đá vẫn được sử dụng phổ biến để bảo quản thực phẩm.
Nhiệt dung riêng của nước đá ở -10°C là 2,03 J/(g·K), trong khi nhiệt dung của hơi nước ở 100°C là 2,08 J/(g·K).
Chú thích
- ^ Nước biển tiêu chuẩn Vienna (VSMOW), dùng để hiệu chuẩn, tan chảy ở 273.1500089(10) K (0.000089(10) °C) và sôi ở 373.1339 K (99.9839 °C). Các thành phần đồng vị khác có nhiệt độ tan chảy và sôi hơi khác nhau.
- ^ Giá trị pKa của nước là 15.7, thường được trích dẫn trong hóa học hữu cơ, là không chính xác.
- ^ H+ đại diện cho H
3O
(H
2O)
n và các ion phức tạp khác hình thành.
