1. Danh sách các chất có phân tử chỉ chứa liên kết cộng hóa trị phân cực
Danh sách các chất có phân tử chỉ chứa liên kết cộng hóa trị phân cực bao gồm:
A. O2, H2O, NH3
B. HCl, O3, H2S
C. H2O, HF, H2S
D. HF, Cl2, H2O
Đáp án đúng là C
Chi tiết: Đáp án A loại bỏ O2, đáp án B loại O3, đáp án D loại Cl2. Đây là các phân tử có liên kết cộng hóa trị không phân cực
2. Một số câu hỏi trắc nghiệm liên quan
Câu 1. Các số oxi hóa của nguyên tố nitơ trong các hợp chất: NH4Cl, HNO3, NO, NO2, N2, N2O là gì?
A. 0, +1, -4, +5, -2, 0
B. -4, +6, +2, -2, +1
C. 0, +2, +3, -5, +2, -4
D. -3, +5, +2, +4, 0, +1
Đáp án là D
Gọi số oxi hóa của N là x, trong các hợp chất có số oxi hóa của H là +1 và O là -2.
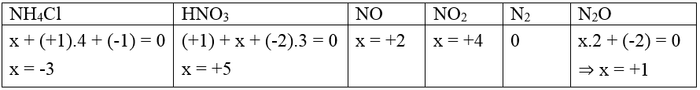
Câu 2. Các số oxi hóa của nguyên tố lưu huỳnh trong các chất: S, H2S, H2SO4, SO2 lần lượt là:
A. 0, +2, +6, +4
B. 0, -2, +4, -4
C. 0, -2, -6, +4
D. 0, -2, +6, +4
Gọi số oxi hóa của S là x
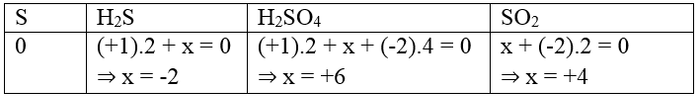
Câu 3. Liên kết hóa học giữa các nguyên tử trong phân tử H2O là loại liên kết nào?
A. Cộng hóa trị không phân cực
B. Cộng hóa trị phân cực
C. Liên kết hidro
D. Ion
Đáp án là B.
Nguyên tử oxy có độ âm điện lớn hơn nhiều so với nguyên tử hidro, và chênh lệch độ âm điện trong phân tử H2O là XO - XH = 1,24 ⇒ Liên kết cộng hóa trị phân cực
Câu 4. Nội dung nào sau đây là sai khi nói về ion?
A. Ion là phần tử mang điện.
B. Ion âm gọi là cation, ion dương gọi là anion.
C. Ion hình thành khi nguyên tử nhường hoặc nhận electron.
D. Ion có thể chia thành ion đơn nguyên tử và ion đa nguyên tử.
Câu 5. Trong các phản ứng hóa học, nguyên tử kim loại thường có xu hướng
A. Nhận thêm electron.
B. Nhường bớt electron.
C. Nhận hay nhường electron tùy thuộc vào từng phản ứng cụ thể.
D. Nhận hay nhường electron tùy thuộc vào từng kim loại cụ thể.
Đáp án là B. Kim loại thường có 1, 2, 3 electron ở lớp ngoài cùng, vì vậy có xu hướng nhường electron.
Câu 6. Hợp chất nào dưới đây có cả liên kết cộng hóa trị phân cực và không phân cực?
A. NH4Br
B. H2O2
C. CH4
D. HF
Đáp án đúng: B
- Trong H2O2, độ âm điện giữa O và H là 1,4 → liên kết O-H có cực.
- Hiệu số độ âm điện giữa O và O bằng 0 → liên kết O-O không phân cực.
Câu 7. Với độ âm điện của oxy và hidro lần lượt là 3,44 và 2,20, vậy trong phân tử H2O, liên kết hóa học là loại nào?
A. Ion
B. Cộng hóa trị không phân cực
C. Cộng hóa trị phân cực
D. Tất cả các đáp án trên đều sai
Hiệu độ âm điện là: 3,44 – 2,20 = 1,24
Vì 0,4 < 1,24 < 1,27 → liên kết cộng hóa trị phân cực.
Đáp án đúng: C
Câu 8. Độ âm điện của nhôm là 1,61, còn của lưu huỳnh là 2,58. Vậy liên kết hóa học trong phân tử Al2S3 là loại nào?
A. Liên kết ion
B. Liên kết cộng hóa trị không phân cực
C. Liên kết cộng hóa trị phân cực
D. Không phải các đáp án trên
Đáp án đúng: C
- Hiệu độ âm điện: 2,58 – 1,61 = 0,97
- 0,4 < 0,97 < 1,7 → liên kết cộng hóa trị phân cực.
Câu 9. Trong các phản ứng hóa học, nguyên tử kim loại thường có xu hướng
A. Nhận thêm electron
B. Nhận hay nhường electron tùy thuộc vào từng phản ứng cụ thể
C. Nhường bớt electron
D. Nhận hay nhường electron tùy thuộc vào từng kim loại cụ thể.
Đáp án đúng: C. Kim loại thường có 1, 2, 3 electron ở lớp ngoài cùng nên có xu hướng nhường electron.D. Sự tương tác giữa các nguyên tử và ion trong mạng tinh thể với dòng electron tự do.
Đáp án đúng: B
3. Các loại liên kết cộng hóa trị là gì?
Có năm loại liên kết cộng hóa trị:
- Liên kết cộng hóa trị phân cực: Xảy ra khi các electron giữa các nguyên tử không được chia sẻ đều, do một bên có độ âm điện cao hơn, dẫn đến sự phân cực về phía nguyên tử có độ âm điện thấp hơn, tạo thành hợp chất có thế tĩnh điện.
- Liên kết cộng hóa trị không phân cực: Các nguyên tử chia sẻ electron đều nhau, thường xảy ra giữa các nguyên tử có độ âm điện tương đương hoặc giống nhau. Trong phân tử khí, nguyên tử có độ âm điện cao hơn sẽ hút electron.
- Liên kết đơn phân tử: Hai nguyên tử chia sẻ một cặp electron duy nhất. Mặc dù yếu hơn và mật độ nhỏ hơn, nhưng loại liên kết này ổn định nhất do phản ứng thấp.
- Liên kết đôi phân tử: Hai nguyên tử trao đổi hai cặp electron cho nhau, mạnh hơn liên kết đơn nhưng ít ổn định hơn.
- Liên kết ba phân tử: Đây là loại liên kết kém ổn định nhất, hình thành khi ba cặp electron được chia sẻ giữa hai nguyên tử trong một phân tử.
4. Tính chất của các chất có liên kết cộng hóa trị là rất đa dạng và phong phú.
Dạng chất: Các phân tử chỉ chứa liên kết cộng hóa trị có thể tồn tại dưới dạng rắn như đường, sắt, lưu huỳnh, hoặc lỏng như rượu, nước, và cũng có thể là khí như clo, cacbonic, hidro.
Điểm nóng chảy và điểm sôi: Các chất này thường có điểm nóng chảy và điểm sôi thấp hơn so với nhiều chất khác.
Entalpi hóa hơi và nhiệt hấp thụ nhiệt thấp: Chúng có entalpi hóa hơi và nhiệt hấp thụ nhiệt thấp hơn các chất khác.
Hòa tan trong dung môi có cực: Các chất như đường và rượu etylic sẽ hòa tan tốt hơn trong dung môi có cực như nước. Ngược lại, các chất không cực như ion sẽ tan trong các dung môi không cực như cacbon tetraclorua và benzen.
Các tính chất của liên kết phân tử LKCHT bao gồm:
- Không tạo ra electron mới mà chỉ có thể trao đổi electron với nhau.
- Đây là các liên kết hóa học cực kỳ mạnh mẽ, tồn tại giữa nhiều nguyên tử.
- Mỗi liên kết thường chứa khoảng 80 kilocalories/mol (kcal/mol).
- Một khi hình thành, chúng rất ít khi bị phá vỡ một cách tự nhiên.
5. Mối liên hệ giữa liên kết cộng hóa trị không cực, liên kết cộng hóa trị có cực và liên kết ion.
Sự tương quan giữa liên kết cộng hóa trị có cực, liên kết cộng hóa trị không cực và liên kết ion rất quan trọng để hiểu cấu trúc và tính chất của các phân tử và hợp chất hóa học.
Trong phân tử, cách phân bố các cặp electron chung rất quan trọng để xác định kiểu liên kết hóa học. Liên kết cộng hóa trị không cực hình thành khi các cặp electron chung giữa hai nguyên tử phân bố đều đặn mà không có sự lệch lạc, thường xảy ra khi hai nguyên tử có độ âm điện gần nhau hoặc tương đương. Ngược lại, liên kết cộng hóa trị có cực xảy ra khi các cặp electron chung lệch về phía nguyên tử có độ âm điện cao hơn, tạo ra sự chênh lệch âm điện và tính chất có cực của liên kết. Liên kết ion thì hình thành khi cặp electron chung lệch hẳn về một nguyên tử, khiến một nguyên tử mất electron thành cation và nguyên tử khác nhận electron thành anion.
Hiểu rõ mối liên hệ này giúp nhận ra rằng liên kết ion có thể coi là một trường hợp đặc biệt của liên kết cộng hóa trị. Trong liên kết ion, sự chuyển động của electron là mạnh mẽ và đặc biệt, dẫn đến sự hình thành cation và anion, tạo ra môi trường điện tích trong phân tử. Trong khi đó, liên kết cộng hóa trị có cực và không cực thường xảy ra giữa các nguyên tử trong phân tử hữu cơ và không hữu cơ, tạo ra cấu trúc và tính chất riêng biệt cho từng loại phân tử.
Liên kết cộng hóa trị có cực thường tạo ra các phân tử có tính chất có cực, dễ tan trong dung môi có tính chất tương tự, trong khi liên kết cộng hóa trị không cực tạo ra các phân tử không có tính chất có cực, dễ tan trong dung môi không có tính chất tương tự. Liên kết ion, với sự chênh lệch electron lớn, tạo ra các phân tử có tính chất điện tích mạnh và khả năng tương tác điện giữa các ion trong dung dịch.
Tóm lại, mối quan hệ giữa liên kết cộng hóa trị có cực, liên kết cộng hóa trị không cực và liên kết ion là phần thiết yếu của hóa học, cung cấp cái nhìn sâu sắc về cấu trúc và tính chất của các phân tử và hợp chất.
Đây là toàn bộ thông tin mà Mytour muốn chia sẻ về chủ đề 'Dãy gồm các chất trong phân tử chỉ có liên kết cộng hóa trị phân cực là? Cảm ơn bạn đọc đã quan tâm và theo dõi!
