1. Công thức hóa học lớp 9 - Các hợp chất vô cơ phổ biến
Các dạng bài tập liên quan đến CO2/SO2 tác dụng với dung dịch kiềm
Oxit axit thường gặp là CO2 và SO2. Các dung dịch kiềm thường được sử dụng là:
Nhóm 1: NaOH, KOH - Kim loại nhóm I
Nhóm 2: Ca(OH)2, Ba(OH)2 - Kim loại nhóm II
Phương pháp giải quyết:
1. Giải bài tập liên quan đến CO2, SO2 đưa vào dung dịch NaOH, KOH
Khi cho CO2 hoặc SO2 tác dụng với dung dịch NaOH, có thể xảy ra ba phản ứng tạo thành muối:
CO2 + 2 NaOH → Na2CO3 + H2O (1)
CO2 + NaOH → NaHCO3 (2)
Đặt T = n NaOH / n CO2
Nếu T = 2 thì chỉ tạo thành muối Na2CO3
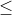
Khi 1 < T < 2, cả hai loại muối NaHCO3 và Na2CO3 đều được tạo thành
2. Bài toán CO2, SO2 tác dụng với dung dịch Ca(OH)2 và Ba(OH)2
Do không biết chính xác sản phẩm muối tạo thành nên cần tính toán tỷ lệ T
Ca(OH)2 + CO2 → CaCO3 + H2O (1)
Ca(OH)2 + 2 CO2 → Ca(HCO3)2 (2)
Đặt T = n CO2 : n Ca(OH)2
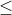
Nếu T = 2, chỉ xuất hiện muối Ca(HCO3)2
Khi 1 < T < 2, cả hai muối CaCO3 và Ca(HCO3)2 sẽ hình thành
3. Ví dụ minh họa
Ví dụ: 4,48 lít khí CO2 ở điều kiện tiêu chuẩn phản ứng hoàn toàn với 400 ml NaOH để tạo ra muối trung hòa
a. Tính khối lượng của muối thu được
b. Xác định nồng độ mol của dung dịch NaOH đã sử dụng
Hướng dẫn chi tiết:
Sản phẩm tạo thành muối trung hòa là Na2CO3
Phương trình hóa học của phản ứng là:
CO2 + 2 NaOH → Na2CO3 + H2O
0,2 → 0,4 → 0,2
Số mol CO2 là: n CO2 = 0,2 mol
a. Khối lượng Na2CO3 thu được: m Na2CO3 = 0,2 × 106 = 21,2 gam
b. Nồng độ mol của dung dịch NaOH đã sử dụng: C MNaOH = 0,4 / 0,4 = 1 M
2. Công thức hóa học lớp 9 - Các hợp chất hữu cơ
1. Phương pháp xác định bằng cách tăng giảm khối lượng
A + B2(SO4)n → A2(SO4)m + B
Trường hợp 1: mA tan < mB bám
mB bám - m A tan = m kim loại tăng
Trường hợp 2: m A tan lớn hơn mB bám
m A tan - m B bám = m kim loại giảm
2. Bảo toàn khối lượng
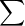
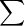
Khối lượng của thanh kim loại và dung dịch ban đầu bằng khối lượng của thanh kim loại và dung dịch sau phản ứng
Phản ứng nhiệt nhôm là:
nH2 = nFe + 3/2. nAl
nH2 = nFe + 3/2. nAl
Trong các phản ứng của C, CO, H2, số mol của CO bằng nCO2
Khối lượng bình tăng = khối lượng hấp thụ
Khối lượng dung dịch tăng = khối lượng hấp thụ - khối lượng kết tủa
Khối lượng dung dịch giảm = khối lượng kết tủa - khối lượng hấp thụ
Hydrocacbon
1. Xác định công thức phân tử của hợp chất hữu cơ
Bước 1: Tính toán phân tử khối của hợp chất hữu cơ
Phân tử khối của hợp chất hữu cơ có thể được xác định theo các phương pháp sau:
Dựa vào khối lượng mol của hợp chất hữu cơ: M = 12x + y + 16z (g/mol)
Dựa vào mối liên hệ giữa khối lượng và số mol: M = m/n
Dựa vào tỷ khối (áp dụng cho khí): dA/B = MA/MB; dA/kk = MA/Mkk = MA/29
- Bước 2: Xác định công thức phân tử của hợp chất hữu cơ
Dựa vào phần trăm khối lượng của các nguyên tố: %mC/12 = %mH/1 = %mO/16
Dựa trên công thức đơn giản nhất: Ký hiệu công thức phân tử, công thức cấu tạo đơn giản nhất = CTĐGN
CTPT = (CTĐGN)n
2. Xác định công thức phân tử qua phản ứng đốt cháy của hợp chất hữu cơ
Bước 1: Viết công thức tổng quát của hợp chất hữu cơ: CxHyOz
Bước 2: Chuyển các đại lượng đề bài thành số mol tương ứng
Bước 3: Lập phương trình tổng quát của phản ứng đốt cháy
CxHyOz + (x + y/4 - z/2)O2 → x CO2 + y/2 H2O
Bước 4: Xác định tỷ lệ số mol của các nguyên tố trong công thức
Tính khối lượng của từng nguyên tố
Bước 5: Xem xét công thức phân tử của hợp chất hữu cơ: M = (CxHyOz)n
Tính giá trị n và M
Dẫn xuất của hidrocacbon - Polime
1. Độ rượu
Khái niệm: Độ rượu là số mol của etanol có trong 100 ml hỗn hợp rượu và nước
Công thức để tính độ rượu:
Độ rượu = (V etanol / V rượu) × 100
2. Công thức tính khối lượng riêng
D = m/V (g/ml)
3. Một số công thức hóa học cần nắm vững thêm
1. Công thức tính phần trăm khối lượng của hóa chất
Khi biết công thức của hợp chất, học sinh có thể tính phần trăm khối lượng của các nguyên tố trong hợp chất đó bằng các bước sau:
Bước 1: Tính khối lượng mol của hợp chất
Bước 2: Xác định số mol của từng nguyên tố trong 1 mol hợp chất AxBy
1 mol phân tử AxBy chứa: x mol nguyên tử A và y mol nguyên tử B
mA = x × MA
mB = y × MB
- Tính phần trăm khối lượng của mỗi nguyên tố bằng công thức:
%mA = (mA / mAxBy) × 100%
% mB = (mB / mAxBy) × 100%
Lưu ý: Công thức trên có thể áp dụng cho hợp chất có 3, 4 hoặc nhiều nguyên tố khác
Ví dụ: Tính phần trăm khối lượng của nguyên tố Al trong nhôm oxit Al2O3
Đối với Al: mAl = 27
MAl = 27 g
Khối lượng phân tử của Al2O3 = 2 × 27 + 3 × 16 = 102 g
MAl2O3 = 102 g
%mAl = (2 × 27 / 102) × 100% = 52,94%
Chúng ta cũng có thể tính phần trăm khối lượng của oxy trong hợp chất:
100% - 52,94% = 47,06%
Ví dụ 2: Xác định phần trăm khối lượng của các nguyên tố trong hợp chất KNO3
Khối lượng mol của KNO3 được tính là: MKNO3 = 39 + 14 + (16 × 3) = 101 g/mol
Trong 1 mol KNO3 chứa: 1 mol nguyên tử K, 1 mol nguyên tử N và 3 mol nguyên tử O
Tính phần trăm khối lượng của các nguyên tố trong KNO3 như sau:
% mK = (39 × 100%) / 101 = 36,8%
% mN = (14 × 100%) / 101 = 13,8%
% mO = (16 × 3 × 100%) / 101 = 47,6%
Hoặc có thể tính % mO bằng cách: 100% - (36,8% + 13,8%) = 47,6%
2. Xác định tỷ lệ khối lượng của các nguyên tố trong hợp chất
Dựa vào công thức hóa học AxBy, ta có thể xác định tỷ lệ khối lượng của các nguyên tố như sau:
mA : mB = x × MA : y × MB
Ví dụ: Tính tỷ lệ khối lượng của nguyên tố carbon và hydro trong khí C2H4
Ta có: Khối lượng carbon = 12 × 2 = 24 gam
Khối lượng hydro = 1 × 4 = 4 gam
Trong 1 mol C2H4, có 2 nguyên tử carbon và 4 nguyên tử hydro
tỉ lệ khối lượng C : H = 2 × 12 : 4 × 1 = 24 : 4 = 6 : 1
Lưu ý: Nếu đã biết tỷ lệ phần trăm khối lượng của các nguyên tố, có thể lập tỷ lệ khối lượng theo phần trăm đó
3. Tính khối lượng của nguyên tố trong một lượng chất đã xác định
Khi biết khối lượng m của một hợp chất với công thức AxBy, có thể tính khối lượng của nguyên tố A (mA) bằng công thức sau:
mA = x × MA / MAxBy × m
VÍ DỤ: Tính khối lượng nguyên tố trong 8 gam muối đồng sunfat CuSO4
Gợi ý đáp án:
Ta có: CuSO4 = 64 + 32 + 64 = 160
M CuSO4 = 160 g
mO = 4 × 16 / 160 × 8 = 3,2 gam
4. Công thức tính phần trăm khối lượng
Cách 1:
- Tính khối lượng mol của hợp chất
- Xác định số mol nguyên tử của từng nguyên tố trong 1 mol hợp chất và chuyển đổi thành khối lượng
- Xác định phần trăm khối lượng của từng nguyên tố trong hợp chất
Cách 2: Áp dụng công thức hóa học: AxByCz
% A = x × MA / Mhc × 100%
% B = y × MB / Mhc × 100%
% C = z × MC / Mhc × 100%
Hoặc % C = 100% - (% A + % B)
Ví dụ: Phosphat tự nhiên, thành phần chính là canxi photphat với công thức hóa học Ca3(PO4)2
Bước 1: Tính khối lượng mol của hợp chất
Bước 2: Tính số mol nguyên tử của từng nguyên tố trong 1 mol hợp chất
Bước 3: Xác định phần trăm khối lượng của mỗi nguyên tố
Bài viết trên Mytour đã cung cấp cho bạn đọc thông tin chi tiết về công thức hóa học lớp 9. Cảm ơn bạn đã theo dõi và đọc bài viết của chúng tôi.
