ĐỀ ÔN LỊCH SỬ MÔN HÓA CHUYÊN VÀO LỚP 10
Câu 1:
1.1 Viết phương trình phản ứng hóa học xảy ra (nếu có) khi các chất CaCO3, CuO, Al2O3 lần lượt phản ứng với các dung dịch sau:
a) Axit clohidric (HCl)
b) Natri hidroxit (NaOH)
1.2 Có 5 bình mất nhãn chứa các dung dịch: Na2CO3, KHSO4, BaCl2, Fe(NO3)2, Al2(SO4)3 được đánh dấu ngẫu nhiên bằng các chữ cái A, B, C, D, E. Thực hiện thí nghiệm với các dung dịch này cho kết quả theo bảng dưới đây:
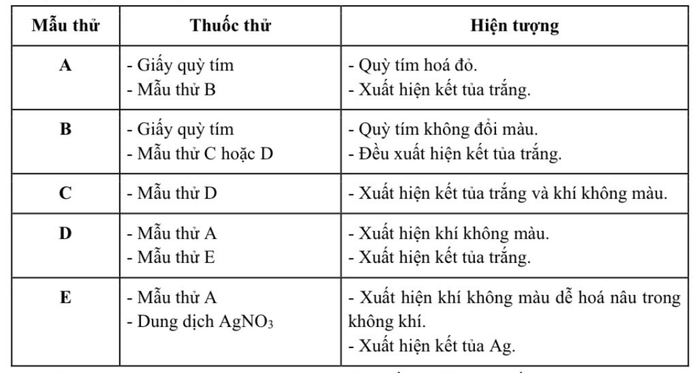
Xác định các dung dịch A, B, C, D, E (không cần giải thích); viết phương trình hóa học phản ứng xảy ra trong thí nghiệm.
1.3 Chalcopyrite là một khoáng vật phổ biến trong tự nhiên với thành phần chủ yếu là chất T (T có công thức XYZ; XYZ2; X và Y là kim loại, Z là phi kim). Khi đốt cháy hoàn toàn chất T trong oxi dư, thu được chất rắn A và khí B. Phân tích chất rắn A cho thấy có hai oxit A1 và A2 (trong A1 và A2, các kim loại có hóa trị cao nhất). Hòa tan hoàn toàn A1 trong dung dịch H2SO4 loãng thu được dung dịch D màu xanh lam (chứa muối của X). Khử A2 bằng khí CO dư, thu được đơn chất Y màu trắng xám, thành phần chính của thép. Trong khí B có khí C gây ô nhiễm không khí. Khi sục B vào dung dịch Br2 dư, thu được dung dịch E và khí F. Dung dịch E tác dụng với dung dịch BaCl
Câu 2:
2.1 Liệt kê hiện tượng và viết phương trình hóa học (nếu có) cho các thí nghiệm dưới đây:
a) Dựa vào hình vẽ, mô tả quy trình điều chế chất Y (hình 1). Hỗn hợp X bao gồm C2H5OH, CH3COOH, H2SO4 đặc và đá bọt
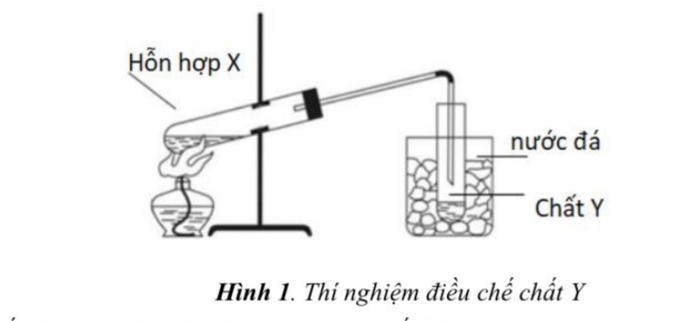
i) Viết phương trình hóa học của phản ứng tạo ra chất Y
ii) Học sinh A đã tắt đèn cồn trước khi tháo ống dẫn hơi chất Y khi kết thúc thí nghiệm. Hãy cho biết hành động của học sinh là đúng hay sai? (không cần giải thích)
b) Thêm giấm (hoặc nước chanh) vào sữa bò hoặc sữa đậu nành
c) Đưa mẫu sodium oxide (Na2O) vào cốc chứa copper (II) sulfate (CuSO4)
2.2 Xem chuỗi các phản ứng hóa học dưới đây (mỗi mũi tên biểu thị một phản ứng)
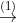
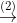
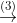
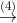
Viết phương trình hóa học cho các phản ứng (ghi rõ điều kiện nếu có). Biết tỷ khối của A so với X nhỏ hơn 1.
2.3 Liên kết hydrogen là loại liên kết yếu, hình thành giữa nguyên tử H (đã liên kết với nguyên tử có độ âm điện cao, thường là F, O, N) và nguyên tử khác có độ âm điện cao hơn (thường là F, O, N) với cặp electron hóa trị chưa tạo liên kết. Liên kết hydrogen thường được ký hiệu bằng ba chấm.
Chất ưa nước (hydrophilic hay 'ưa nước') trong phân tử thường chứa nhóm O-H hoặc N-H, có khả năng tạo liên kết hydrogen với nước, nên dễ hòa tan trong nước. Ví dụ, ethanol (C2H5OH) hòa tan tốt trong nước nhờ tạo liên kết hydrogen (hình 2). Ngược lại, chất kỵ nước (hydrophobic hay 'sợ nước') thường chứa liên kết C-H không tương tác tốt với nước, nên chủ yếu không hòa tan trong nước.
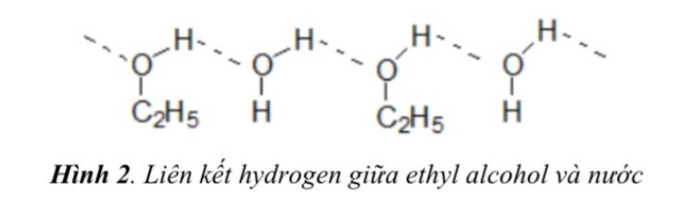
Trong cơ thể, các chất ưa nước được bài tiết nhanh hơn và cần bổ sung hàng ngày trong chế độ ăn uống. Ngược lại, chất kỵ nước tan trong chất béo, có xu hướng tích tụ trong mô mỡ và lưu trữ lâu dài.
Các hợp chất như caffeine, acetaminophen, vitamin C và vitamin D thường xuất hiện trong chế độ ăn uống của con người và có công thức cấu tạo dưới đây:
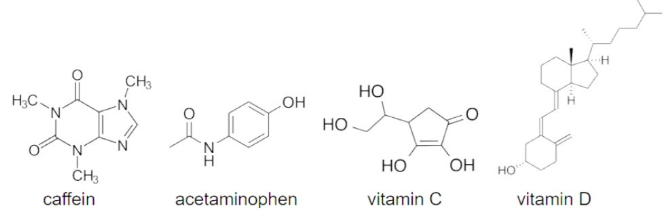
a) Xác định các chất ưa nước và kỵ nước trong danh sách, đồng thời dự đoán tốc độ bài tiết của chúng ra khỏi cơ thể (không cần giải thích)
b) Vẽ lại cấu trúc của acetaminophen và khoanh tròn các nguyên tử có khả năng tạo liên kết hydrogen với nguyên tử H của nước
Câu 3:
3.1 Hòa tan hoàn toàn m gam bột Mg vào 100ml dung dịch hỗn hợp FeCl3 0,2M và CuCl2 0,3M. Sau khi phản ứng hoàn tất, thu được 2,76 gam chất rắn. Tính giá trị của m
3.2 Cho m gam natri vào 500 ml dung dịch HCl aM (D=1,12g/mL). Sau khi phản ứng hoàn tất, thu được 586,4 gam dung dịch E (giả sử nước bay hơi không đáng kể). Dung dịch E có thể hòa tan tối đa 0,54 gam nhôm. Xác định giá trị của m và a
3.3 Hỗn hợp A dạng bột gồm Al, F, Cu, và FeCO3. Cân 5,0 gam A cho vào một cốc thủy tinh chịu nhiệt và thực hiện các bước sau:
+ Bước 1: Thêm 120 mL dung dịch NaOH 0,2M vào cốc thủy tinh chứa hỗn hợp A, phản ứng xảy ra sinh ra 0,7437 lít khí H2 (ở điều kiện tiêu chuẩn)
+ Bước 2: Tiếp tục cho 162 mL dung dịch HCl 1M vào cốc thủy tinh và đun nóng, thu được hỗn hợp khí B và một phần chất rắn chưa tan D (gồm 2 loại kim loại). Dẫn khí B vào dung dịch Ca(OH)2 dư, xuất hiện 2,5 gam kết tủa. Lọc lấy phần chất rắn D.
+ Bước 3: Xử lý chất rắn D với dung dịch H2SO4 đặc, nóng, dư, thu được dung dịch E và 0,47101 lít khí duy nhất (ở điều kiện tiêu chuẩn)
+ Bước 4: Đưa dung dịch E vào tác dụng với dung dịch NaOH dư, thu được kết tủa F. Lọc để lấy kết tủa F.
+ Bước 5: Nung kết tủa F đến khi khối lượng không đổi, được m gam chất rắn.
a) Tính phần trăm khối lượng của Al và Cu trong hỗn hợp A.
b) Xác định giá trị của m.
Câu 4:
4.1 Khi hoàn toàn hydrogen hoá 5,34 gam hỗn hợp gồm methane (CH4) và hydrocacbon X (tỷ lệ mol là 3:5), cần 0,3 mol H2 (xúc tác, nhiệt độ) để tạo ra hỗn hợp Y. Đốt cháy hết Y cần 0,705 mol O2, thu được CO2 và H2. Xác định công thức phân tử của X và tính phần trăm khối lượng của mỗi chất trong hỗn hợp Y.
4.2 Động cơ X sử dụng xăng (giả sử là isooctane C8H18) và không khí (21% O2 và 79% N2) với 4 xilanh có dung tích bằng nhau. Mỗi xilanh đốt cháy 0,399 gam xăng và 0,325 mol không khí. Sau khi cháy hết, hỗn hợp khí thải gồm CO, CO2, và H2O. Biết 10% xăng chuyển thành CO, còn lại thành CO2.
a) Tính số mol của từng chất trong khí thải từ một xilanh.
b) Dựa vào dữ liệu trên, tính lượng nhiệt tỏa ra môi trường của động cơ X. Biết rằng khi đốt cháy hoàn toàn 1,000 mol xăng, giải phóng 4924,656 kJ, trong đó 40% dùng để sinh công, phần còn lại tỏa ra môi trường.
4.3 Trong bình kín 2 lít chứa m gam alcohol X ở 273oC, áp suất 1,1341 bar. Đốt cháy m gam X, thu được H2O và 3,7185 lít CO2 (đktc). Khi cho m gam X tác dụng với dư acetic acid (CH3COOH), thu được 6,54 gam ester Y (chứa nhóm COO), giả sử hiệu suất phản ứng là 60%. R=0,082; T=(toC + 273); 1 atm = 1,01325 bar.
a) Tìm công thức phân tử của X.
b) Đun 10,296 kg chất béo E với dung dịch sodium hydroxide (NaOH) vừa đủ, thu được 1,104 kg chất X và m kg hỗn hợp muối sodium của các acid béo. Tính khối lượng xà phòng thu được từ m kg hỗn hợp muối, biết rằng muối của các acid béo chiếm 75% khối lượng xà phòng.
