
| Dimethylfomamide | |||
|---|---|---|---|
|
| |||
| Danh pháp IUPAC | N,N-Dimethylformamide | ||
| Tên khác | Dimethylformamide N,N-Dimethylmethanamide DMF | ||
| Nhận dạng | |||
| Số CAS | 68-12-2 | ||
| PubChem | 6228 | ||
| Số EINECS | 200-679-5 | ||
| DrugBank | |||
| KEGG | C03134 | ||
| MeSH | Dimethylformamide | ||
| ChEBI | 17741 | ||
| Số RTECS | LQ2100000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ | ||
| InChI | đầy đủ | ||
| ChemSpider | 5993 | ||
| Tham chiếu Beilstein | 605365 | ||
| 3DMet | B00545 | ||
| Thuộc tính | |||
| Công thức phân tử | (CH3)2NC(O)H | ||
| Bề ngoài | Chất lỏng không màu | ||
| Mùi | tanh, ammoniac | ||
| Khối lượng riêng | 0.948 g/mL | ||
| Điểm nóng chảy | −78 °C (195 K; −108 °F) | ||
| Điểm sôi | 153 °C (426 K; 307 °F) | ||
| Độ hòa tan trong nước | không tan | ||
| log P | −0.829 | ||
| Áp suất hơi | 516 Pa | ||
| Độ axit (pKa) | -0.3 (for the conjugate acid) (H2O) | ||
| LambdaMax | 270 nm | ||
| Absorbance | 1.00 | ||
| Chiết suất (nD) | 1.4305 (at 20 °C) | ||
| Độ nhớt | 0.92 mPa s (at 20 °C) | ||
| Cấu trúc | |||
| Mômen lưỡng cực | 3.86 D | ||
| Nhiệt hóa học | |||
| Enthalpy hình thành ΔfH298 | −239.4 ± 1.2 kJ/mol | ||
| DeltaHc | −1.9416 ± 0.0012 MJ/mol | ||
| Nhiệt dung | 146.05 J/(K·mol) | ||
| Các nguy hiểm | |||
| NFPA 704 |
2
2
0
| ||
| Giới hạn nổ | 2.2–15.2% | ||
| PEL | TWA 10 ppm (30 mg/m³) [skin] | ||
| LC50 | 3092 ppm (chuột, 2 h) | ||
| LD50 |
| ||
| REL | TWA 10 ppm (30 mg/m³) [skin] | ||
| IDLH | 500 ppm | ||
| Ký hiệu GHS | |||
| Báo hiệu GHS | Nguy hiểm | ||
| Chỉ dẫn nguy hiểm GHS | H226, H312, H319, H332, H360 | ||
| Chỉ dẫn phòng ngừa GHS | P280, P305+P351+P338, P308+P313 | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa).
(cái gì ?)
Tham khảo hộp thông tin | |||
Dimetilformamid là một hợp chất hữu cơ có công thức (CH3)2NC(O)H. Thường được viết tắt là DMF (mặc dù cách viết tắt này đôi khi được sử dụng cho dimetyl furan, hoặc dimetil fumarat), chất lỏng không màu này có thể trộn lẫn với nước và phần lớn các chất lỏng hữu cơ. DMF là dung môi phổ biến cho các phản ứng hóa học. Dimetilformamid không mùi, nhưng các mẫu kỹ thuật hoặc các mẫu phân huỷ thường có mùi tanh do tạp chất dimetilamin. Các tạp chất phân huỷ dimetylamin có thể được loại bỏ bằng cách phun các mẫu phân huỷ bằng khí trơ như argon hoặc bằng cách làm nóng mẫu dưới áp suất giảm. Như tên của nó đã cho thấy, nó là một dẫn xuất của formamit, amit của axit formic. DMF là một dung môi aprotic phân cực (không có nước) có nhiệt độ sôi cao. Nó tạo điều kiện cho các phản ứng theo cơ chế phân cực, chẳng hạn như phản ứng SN2.
Cấu trúc và thuộc tính
Đối với hầu hết các amit, chứng minh phổ quang chỉ ra tính chất liên kết đôi một phần đối với liên kết C-N và C-O. Do đó, phổ hồng ngoại cho thấy tần số kéo dài của C=O chỉ ở 1675 cm, trong khi keton sẽ hấp thụ gần 1700 cm. DMF là một ví dụ về phân tử thông lượng.
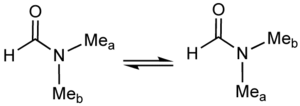
Phổ H NMR ở nhiệt độ phòng chỉ ra hai tín hiệu metyl, chỉ ra sự phức tạp của liên kết (O)C-N. Ở nhiệt độ gần 100 °C, phổ NMR 500 MHz của hợp chất này chỉ cho một tín hiệu cho nhóm metyl.
DMF có thể hòa tan trong nước. Áp suất hơi ở 20 °C là 3,5 hPa. Luật Henry liên tục với hằng số là 7,47×10 hPa m³ mol có thể suy ra từ một hằng số cân bằng được xác định trong điều kiện thực tế ở 25 °C. Hệ số phân bố log POW đo được là -0,85. Do mật độ của DMF (0,95 g cm ở 20 °C) tương tự với của nước, không có sự phân tầng đáng kể mong đợi ở lớp nước mặt trong trường hợp mất mát ngẫu nhiên.

Bên trái: hai cấu trúc cộng hưởng của DMF. Bên phải: minh họa sự nổi bật tính năng phân tách.
Phản ứng
DMF bị thủy phân bởi axit và bazơ mạnh, đặc biệt là ở nhiệt độ cao. Với natri hydroxit, DMF chuyển thành fomiat và dimetylamin. DMF trải qua quá trình khử carbonyl gần nhiệt độ sôi của nó để tạo ra dimetylamin. Do đó, quá trình chưng cất được tiến hành dưới áp suất giảm ở nhiệt độ thấp hơn.
Trong một trong những ứng dụng chính của nó trong tổng hợp hữu cơ, DMF là một chất phản ứng trong phản ứng Vilsmeier-Haack, được sử dụng để tạo thành các hợp chất thơm formylat. Quá trình này bao gồm chuyển đổi ban đầu DMF thành ion chloroiminium, [(CH3)2N=CH(Cl)], được gọi là thuốc thử Vilsmeier, tấn công các ion.
Các hợp chất organolithium và thuốc thử Grignard phản ứng với DMF để tạo ra aldehyde sau khi thủy phân trong một phản ứng được đặt tên là Bouveault.
Hình thức dimetylformamid 1: 1 adducts với nhiều Lewis Acid như axit mềm tôi 2, và axit cứng phenol. Nó được phân loại là đế Lewis cứng và các thông số cơ bản của mô hình ECW của nó là EB = 2,19 và CB = 1,31. Độ mạnh của chất cho tương đối của nó đối với một loạt axit, so với các bazơ Lewis khác, có thể được minh họa bằng đồ thị CB.
Sản xuất
DMF lần đầu tiên được điều chế vào năm 1893 bởi nhà hóa học người Pháp Albert Verley (8 tháng 1 năm 1867 - 27 tháng 11 năm 1959), bằng cách chưng cất một hỗn hợp của dimetylamin hydroclorua và kali fomat.
DMF được sản xuất bằng cách phối hợp methyl formate và dimethylamine hoặc bằng phản ứng của dimethylamine với carbon monoxide.
Mặc dù hiện nay không thực tế, nhưng DMF có thể được sản xuất từ carbon dioxide siêu tới hạn bằng cách sử dụng các chất xúc tác dựa trên ruthenium.
Ứng dụng
Công dụng chính của DMF là làm dung môi có tốc độ bay hơi thấp. DMF được sử dụng trong sản xuất sợi và nhựa acrylic. Nó cũng được sử dụng làm dung môi trong quá trình ghép nối peptit cho dược phẩm, trong phát triển và sản xuất thuốc trừ sâu, và trong sản xuất chất kết dính, da tổng hợp, sợi, màng và chất phủ bề mặt.
- Nó được sử dụng làm thuốc thử trong quá trình tổng hợp aldehyde Bouveault và trong phản ứng Vilsmeier-Haack, một phương pháp hữu ích khác để tạo thành aldehyde.
- Nó là một dung môi phổ biến trong phản ứng Heck.
- Nó cũng là chất xúc tác phổ biến được sử dụng trong quá trình tổng hợp acyl halogenua, đặc biệt là tổng hợp acyl clorua từ axit cacboxylic bằng cách sử dụng oxalyl hoặc thionyl clorua. Cơ chế xúc tác dẫn đến sự hình thành thuận nghịch của imidoyl clorua:
- Me2NC(O)H + (COCl)2 → CO + CO2 + [Me2N=CHCl]Cl
Chất trung gian iminium phản ứng với axit cacboxylic, trừu tượng hóa một oxit và tái tạo chất xúc tác DMF.
- DMF thâm nhập vào hầu hết các loại nhựa và làm cho chúng phồng lên. Do đặc tính này nên DMF thích hợp cho quá trình tổng hợp peptit pha rắn và là một thành phần của chất tẩy sơn.
- DMF được sử dụng làm dung môi để thu hồi olefin như 1,3-butadiene thông qua chưng cất chiết xuất.
- Nó cũng được sử dụng trong sản xuất thuốc nhuộm dung môi như một nguyên liệu thô quan trọng. Nó được tiêu thụ trong quá trình phản ứng.
- Khí axetylen tinh khiết không thể được nén và lưu trữ mà không có nguy cơ cháy nổ. Axetylen công nghiệp được nén một cách an toàn với sự hiện diện của đimetylfomamit, tạo thành một dung dịch cô đặc, an toàn. Vỏ cũng được làm đầy bằng agamassan, đảm bảo an toàn khi vận chuyển và sử dụng.
Sử dụng hợp lý
Là một loại thuốc thử rẻ tiền và thông dụng, DMF có nhiều ứng dụng trong phòng thí nghiệm nghiên cứu.
- DMF được chứng minh có hiệu quả trong việc phân tách và ngăn chặn các ống nano cacbon, và được NIST khuyến nghị sử dụng trong quang phổ hồng ngoại gần của chất này.
- DMF có thể được sử dụng như một tiêu chuẩn trong quang phổ NMR proton để xác định lượng một hợp chất chưa biết.
- Trong quá trình tổng hợp các hợp chất hữu cơ kim, nó được sử dụng làm nguồn tạo phối tử cacbon monoxit.
- DMF là một dung môi phổ biến được sử dụng trong điện hóa.
- DMF thường được sử dụng trong quá trình tổng hợp hóa nhiệt của khung kim loại-hữu cơ.
- DMF-d7 với sự hiện diện của một lượng xúc tác KOt-Bu trong điều kiện gia nhiệt vi sóng là một chất thử để khử độc các hydrocacbon thơm đa vòng.
An toàn
Các phản ứng bao gồm việc sử dụng natri hydrua trong DMF làm dung môi hơi nguy hiểm. Sự phân hủy nhiệt đã được báo cáo xảy ra ở nhiệt độ thấp hơn 26 °C. Ở quy mô phòng thí nghiệm, mọi sự cố về nhiệt thường được phát hiện và kiểm soát nhanh chóng bằng bể nước đá, điều này vẫn là phương pháp phổ biến để xử lý các tình huống này. Mặt khác, ở quy mô nhà máy thí điểm, đã có một số vụ tai nạn được ghi nhận.
Vào ngày 20 tháng 6 năm 2018, Cơ quan Bảo vệ Môi trường Đan Mạch đã xuất bản một bài báo về việc sử dụng DMF trong squishies. Mật độ của hợp chất trong đồ chơi này đã dẫn đến việc rút tất cả các loại mực khỏi thị trường Đan Mạch. Squishies đã được khuyến cáo nên được vứt bỏ như rác thải sinh hoạt.
Độc tính
LD50 cấp tính (qua đường miệng, trên chuột cống và chuột nhắt) là từ 2,2 đến 7,55 g/kg. Các mối nguy hiểm của DMF đã được đánh giá.
Hợp chất nitơ |
|---|
