Trong hóa học, đồng phân là các hợp chất hữu cơ có cùng công thức phân tử nhưng khác nhau về cấu trúc phân tử. Điều này có nghĩa là chúng có công thức hóa học khai triển khác nhau. Các chất đồng phân không nhất thiết phải có tính chất hóa học giống nhau trừ khi chúng có cùng nhóm chức. Cần phân biệt đồng phân với đồng phân hạt nhân, nơi các hạt nhân ở các trạng thái kích thích khác nhau.
Một ví dụ đơn giản về đồng phân là propanol: nó có công thức C3H8O (hay C3H7OH) với hai dạng đồng phân là Propan-1-ol (rượu n-propyl; I) và Propan-2-ol (rượu isopropyl; II)
Lưu ý rằng vị trí của nguyên tử oxy khác nhau trong hai đồng phân này: trong đồng phân đầu tiên, oxy gắn vào nguyên tử carbon cuối cùng, còn trong đồng phân thứ hai, oxy gắn vào nguyên tử carbon ở giữa. Số lượng đồng phân có thể gia tăng khi số lượng nguyên tử tăng; ví dụ, rượu tiếp theo sau propanol là butanol (C4H10O), có 4 dạng đồng phân khác nhau.
Trong ví dụ trước, cần lưu ý rằng cả hai đồng phân đều có liên kết cộng hóa trị; không có loại liên kết nào có trong một đồng phân mà không có trong đồng phân kia. Số lượng liên kết là giống nhau. Dựa vào cấu trúc của hai phân tử, có thể suy luận rằng sự ổn định hóa học của chúng có thể tương đương hoặc gần giống nhau.
Tuy nhiên, có một đồng phân khác của C3H8O với các tính chất khác biệt đáng kể: đó là Methyl Ethyl ether (III). Trong trường hợp này, nguyên tử oxy kết nối với hai nguyên tử carbon, khác với hai chất trong ví dụ trên, nơi oxy nối với một nguyên tử carbon và một nguyên tử hydro. Vì thiếu nhóm hydroxyl, phân tử này không phải là rượu mà được phân loại là ether và có các tính chất hóa học tương tự như các ether khác, không giống với hai dạng rượu đồng phân trước đó.
Một ví dụ khác về các đồng phân với tính chất rất khác nhau có thể thấy trong các hợp chất xanthine. Theobromine (C7H8N4O2) có trong chocolate, nhưng nếu một nhóm methyl được chuyển đến vị trí khác trên cấu trúc hai vòng, đồng phân của nó là theophylline, được sử dụng như một thuốc điều trị bệnh suyễn.
Allen (CH2=C=CH2) và propyn (CH3C≡CH) với công thức chung C3H4 là ví dụ về các đồng phân chứa các loại liên kết khác nhau. Allen có hai liên kết đôi, trong khi propyn có một liên kết ba.
Phân loại
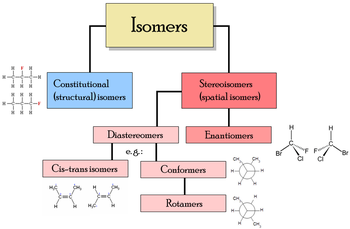
Hiện tượng đồng phân chủ yếu chia thành hai loại: đồng phân cấu trúc (constitutional isomerism hay structural isomerism) và đồng phân lập thể (stereoisomerism).
Trong đồng phân cấu trúc, các nguyên tử và nhóm chức liên kết theo nhiều cách khác nhau, như ví dụ về hai đồng phân rượu của prôpanol. Nhóm này gồm đồng phân chuỗi với các chuỗi hiđrôcacbon có số lượng nhánh khác nhau; đồng phân vị trí với vị trí khác nhau của nhóm chức trên chuỗi; và đồng phân nhóm chức với sự phân chia nhóm chức thành các nhóm khác biệt.
Trong đồng phân lập thể, cấu trúc liên kết giống nhau nhưng các nguyên tử và nhóm chức có vị trí hình học khác nhau trong không gian. Nhóm này bao gồm các đồng phân đối hình (enantiomer), trong đó các đồng phân là hình phản chiếu của nhau, và các đồng phân phi đối hình (diastereomer), trong đó chúng không phải là hình phản chiếu. Đồng phân phi đối hình lại chia thành đồng phân cấu hình riêng (conformer) với khả năng hoán chuyển nhờ quay liên kết hóa học và đồng phân cis-trans (cis-trans isomer) không thể hoán chuyển. Lưu ý rằng dù các đồng phân hình thể có thể coi là phi đối hình, nhưng khi xét tổng thể, chúng không phải là đồng phân phi đối hình vì các liên kết trong chúng có thể quay để tạo ra hình phản chiếu.
Trong hóa thực phẩm, hóa y học và hóa sinh học, các đồng phân cis-trans luôn được chú ý. Trong hóa y học và hóa sinh học, các đồng phân đối hình rất quan trọng vì nhiều thay đổi trong các kiểu đồng phân này có ảnh hưởng đáng kể đến các cơ thể sống. Các phương pháp ghi sắc học có thể tách các đồng phân này một cách chính xác, nhưng ở quy mô công nghiệp, những phương pháp này rất tốn kém và chủ yếu dùng để loại bỏ các đồng phân độc hại tiềm ẩn.
Khi các đồng phân cấu trúc thường có các tính chất hóa học khác nhau, các đồng phân lập thể thường phản ứng hóa học gần như đồng nhất trong hầu hết các trường hợp. Tuy nhiên, enzym có khả năng phân biệt các đồng phân lập thể của cùng một hợp chất, và sinh vật thường ưa thích một đồng phân lập thể hơn các đồng phân còn lại. Một số đồng phân lập thể cũng khác biệt về cách chúng làm quay ánh sáng phân cực.
Ngoài các kiểu đồng phân đã đề cập, còn có các dạng đồng phân khác. Các đồng phân tôpô, hay đồng phân tôpô, thường là các phân tử lớn có thể cuộn xoắn và tạo thành các vòng lặp hoặc nút thắt với hình dạng khác nhau. Ví dụ, các catenan và ADN đều có các đồng phân tôpô. Enzym đồng phân tôpô có khả năng tạo ra các nút thắt trong ADN, từ đó thay đổi hình dáng và kích thước của nó. Cũng có các đồng phân đồng vị (isotopomer) với cùng số lượng các thay thế đồng vị nhưng ở các vị trí hóa học khác nhau. Trong vật lý hạt nhân, các đồng phân hạt nhân là các trạng thái kích thích của hạt nhân nguyên tử.
Lịch sử
Hiện tượng đồng phân lần đầu được ghi nhận vào năm 1827 khi Friedrich Woehler điều chế axít xyanic và phát hiện rằng dù thành phần nguyên tố của nó giống với axít fulminic (do Justus von Liebig điều chế năm trước), nhưng các thuộc tính của chúng lại khác biệt hoàn toàn. Phát hiện này đã thách thức kiến thức hóa học của thời kỳ đó, khi người ta tin rằng các hợp chất hóa học chỉ có thể khác biệt nếu chúng có thành phần nguyên tố khác nhau. Sau đó, các phát hiện bổ sung về hiện tượng tương tự, như việc Woehler phát hiện ra urê có thành phần nguyên tử giống với xyanat amôniắc nhưng khác biệt về mặt hóa học, đã dẫn đến việc Jöns Jakob Berzelius đặt tên cho hiện tượng này là isomerism (đồng phân).
Vào năm 1849, Louis Pasteur đã tách các tinh thể nhỏ của axít tartaric thành hai dạng hình ảnh phản chiếu của nhau. Các phân tử của mỗi dạng này là các đồng phân lập thể trái và phải về mặt quang học, và dung dịch của chúng làm quay mặt phẳng của ánh sáng phân cực theo các hướng ngược nhau. Thay đổi cấu hình nhỏ có thể ảnh hưởng lớn đến tính chất của các hợp chất hóa học.
