1. Giải đáp câu hỏi
Dung dịch FeSO4 và CuSO4 phản ứng với
A. Cu
B. Ag
C. Zn
D. Fe
Hướng dẫn giải chi tiết:
Danh sách các cặp oxi hóa - khử được sắp xếp như sau:
Zn2+/ Zn; Fe2+/ Fe; Cu2+/ Cu cho thấy Fe2+ và Cu2+ có khả năng oxi hóa mạnh hơn Zn2+, vì vậy chúng có thể oxi hóa Zn thành Zn2+.
Zn + Fe2+ → Fe + Zn2+
Zn + Cu2+ → Cu + Zn2+
Đáp án là C
2. Các câu hỏi trắc nghiệm liên quan
Câu 1: Các hỗn hợp chất nào sau đây không thể cùng tồn tại trong một dung dịch?
A. Ni(NO3)2 và AgNO3
B. Fe(NO3)2 và Cu(NO3)2
C. Fe(NO3)2 và AgNO3
D. Hg(NO3)2 và Cu(NO3)2
Đáp án là C
Câu 2: Khi cho bột Fe vào dung dịch AgNO3 dư, dung dịch X thu được sau thí nghiệm chứa:
A. Fe(NO3)3 và AgNO3
B. Fe(NO3)2 và AgNO3
C. Fe(NO3)2 và H2O
D. Fe(NO3)2, Fe(NO3)3 và AgNO3
Đáp án là A
Phương trình phản ứng hóa học
2AgNO3 + Fe → 2Ag + Fe(NO3)2
AgNO3 + Fe(NO3)2 → Ag + Fe(NO3)3
Câu 3: Khi cho hỗn hợp Fe và Mg vào dung dịch AgNO3, sau khi các phản ứng hoàn tất, dung dịch X thu được chứa hai muối và chất rắn Y gồm hai kim loại. Hai muối trong dung dịch X là
A. Mg(NO3)2 và Fe(NO3)2
B. Fe(NO3)3 và Mg(NO3)2
C. AgNO3 và Mg(NO3)2
D. Fe(NO3)2 và AgNO3
Đáp án là A
Giải thích:
Chất rắn Y bao gồm hai kim loại có tính khử yếu nhất là: Ag và Fe
Dung dịch X chứa hai muối của kim loại có tính khử mạnh nhất, với Fe dư
→ Hai muối trong dung dịch X là Mg(NO3)2 và Fe(NO3)2.
Mg + 2Ag+ → Mg2+ + 2Ag↓
Fe + 2Ag+ → Fe2+ + 2Ag ↓
Câu 4: Kim loại X phản ứng với dung dịch H2SO4 loãng, còn kim loại Y phản ứng với dung dịch Fe(NO3)3. X và Y lần lượt là (biết thứ tự trong dãy thế điện hoá: Fe3+/Fe2+ đứng trước Ag+/Ag)
A. Ag, Mg
B. Cu, Fe
C. Fe, Cu
D. Mg, Ag
Đáp án là C
X phản ứng với dung dịch H2SO4 cho thấy X đứng trước H trong dãy điện hóa, vì vậy loại đáp án B (có Cu) và đáp án A (có Ag)
Y phản ứng với Fe3+, vì vậy loại đáp án D
Đáp án C: X là Fe, Y là Cu
Fe + H2SO4 loãng → FeSO4 + H2↑
Cu + 2Fe(NO3)3 → 2Fe(NO3)2 + Cu(NO3)2
Câu 5: Khi cho khí CO (dư) vào ống sứ nung nóng chứa hỗn hợp X gồm Al2O3, MgO, Fe3O4, CuO, thu được chất rắn Y. Khi cho Y vào dung dịch NaOH (dư) và khuấy kĩ, phần không tan Z là
A. MgO, Fe3O4, Cu
B. Mg, Fe, Cu
C. MgO, Fe, Cu
D. Mg, Al, Fe, Cu
Đáp án là A
CO có khả năng khử các oxit của kim loại đứng sau Al trong dãy hoạt động hóa học.
CO + Al2O3 → không phản ứng
CO + MgO → không phản ứng
4CO + Fe3O4 → 3Fe + 4CO2
CO + CuO → Cu + CO2
→ Hỗn hợp Y gồm: Al2O3, MgO, Cu, Fe
Al2O3 + 2NaOH → 2NaAlO2 + H2O
→ Hỗn hợp Z gồm: MgO, Fe, Cu
Câu 6: X là kim loại phản ứng với dung dịch H2SO4 loãng, còn Y là kim loại phản ứng với dung dịch Fe(NO3)3. X và Y lần lượt là (biết thứ tự trong dãy thế điện hoá: Fe3+/Fe2+ đứng trước Ag+/Ag)
A. Fe, Cu
B. Cu, Fe
C. Ag, Mg
D. Mg, Ag
Đáp án là A
Giải thích: X phản ứng với dung dịch H2SO4, do đó X đứng trước H trong dãy điện hóa
→ Loại đáp án B vì có Cu và đáp án C vì có Ag
Y phản ứng với Fe3+, vì vậy loại đáp án D
Đáp án A: X là Fe, Y là Cu. Phản ứng: Fe + H2SO4 loãng → FeSO4 + H2↑
Cu + 2Fe(NO3)3 → 2Fe(NO3)2 + Cu(NO3)2
Câu 7: Cho khí H2 dư qua hỗn hợp oxit CuO, Fe2O3, ZnO, MgO nung nóng. Sau khi phản ứng, chất rắn còn lại là
A. Cu, Fe, ZnO, MgO
B. Cu, Fe, Zn, Mg
C. Cu, Fe, Zn, MgO
D. Cu, FeO, ZnO, MgO
Đáp án C
Giải thích: CuO, Fe2O3, ZnO bị khử bởi C, CO, H2 thành Cu, Fe, Zn. Còn lại MgO. Do đó, chất rắn còn lại là Cu, Fe, Zn, MgO.
Câu 8: Đưa hỗn hợp kim loại Mg, Zn, Fe vào dung dịch chứa AgNO3 và Cu(NO3)2. Sau khi các phản ứng kết thúc, thu được dung dịch X với 3 loại muối và chất rắn Y gồm 3 kim loại. Ba muối có trong X là
A. Mg(NO3)2, Fe(NO3)3, AgNO3
B. Mg(NO3)2, Zn(NO3)2, Cu(NO3)2
C. Mg(NO3)2, Zn(NO3)2, Fe(NO3)3
D. Mg(NO3)2, Zn(NO3)2, Fe(NO3)2
Đáp án D
Giải thích: Dãy điện hóa gồm: Mg2+/Mg; Zn2+/Zn; Fe2+/Fe; Cu2+/Cu; Ag+/Ag
→ Dung dịch X chứa 3 muối với các ion có khả năng oxi hóa yếu nhất, là Mg(NO3)2, Zn(NO3)2 và Fe(NO3)2
3. Kiến thức về dãy điện hóa kim loại
- Dãy điện hóa kim loại: Là danh sách các kim loại được sắp xếp theo khả năng của chúng trong việc tham gia vào quá trình điện phân hoặc oxi hóa trong dung dịch. Dãy này giúp dự đoán khả năng của một kim loại trong việc oxi hóa kim loại khác.
- Ý nghĩa của dãy điện hoá kim loại là gì?
Các kim loại ở vị trí trước trong dãy có tính khử mạnh hơn những kim loại ở vị trí sau. Ngược lại, các kim loại ở vị trí sau có tính oxi hóa mạnh hơn các kim loại ở vị trí trước.
Ví dụ: Ag2+ + Cu → Cu2+ + Ag (kết tủa)
Quy tắc α cũng có những trường hợp ngoại lệ.
Ví dụ:
Kim loại kiềm đầu dãy không thể khử kim loại khác mà thay vào đó sẽ phản ứng với nước.
2K + 2H2O → 2KOH + H2
Các kim loại từ Mg đến trước Hidro khi phản ứng với dung dịch axit sẽ tạo ra muối và giải phóng khí hidro.
Ví dụ:
Fe + 2HCl → FeCl2 + H2
Al, Fe, Cr không phản ứng với HNO3 đặc nguội và H2SO4 đặc nguội.
Các kim loại ở cuối dãy như Au, Pt không phản ứng với axit.
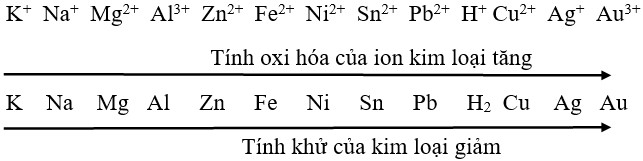
Dãy điện hóa của kim loại cung cấp thông tin về khả năng oxi hóa và khử của chúng.
- Xác định hướng của phản ứng oxi hóa - khử:
Quy tắc α
Khi viết phương trình phản ứng oxi hóa - khử, ta đặt cặp oxi hóa - khử với thế điện cực chuẩn thấp bên trái và cặp có thế điện cực chuẩn cao hơn bên phải, sau đó viết theo quy tắc α.
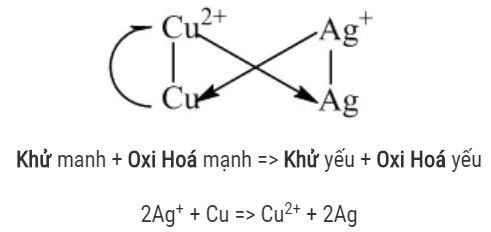
Xác định suất điện động chuẩn của pin điện hóa.
Eopin = Eo (+) - Eo (-)
- Đặc điểm của kim loại trong dãy điện hóa
Từ dãy điện hóa đầy đủ của kim loại, ta có thể suy ra các đặc điểm hóa học của chúng. Vậy kim loại có những đặc tính hóa học gì?
Đặc trưng hóa học nổi bật của kim loại là tính khử. Công thức tổng quát như sau:
R → Rn+ + ne (với 1 ≤ n ≤ 3).
+ Phản ứng với phi kim
Kim loại có khả năng phản ứng với phi kim để tạo ra muối, chẳng hạn như với clo, oxi hay lưu huỳnh. Các muối hình thành thường sẽ kết tủa.
Ví dụ:
Phản ứng với lưu huỳnh: Hg + S → HgS
+ Phản ứng với dung dịch axit
Kim loại có thể phản ứng với dung dịch axit để tạo ra muối và giải phóng khí hoặc nước. Tuy nhiên, có một số trường hợp ngoại lệ, theo dãy điện hóa kim loại, không phản ứng với dung dịch axit. Khi tác dụng với dung dịch HCl hoặc H2SO4 loãng, kim loại khử H+ thành H2.
Ví dụ:
Zn + 2HCl → ZnCl2 + H2
Khi kim loại phản ứng với dung dịch HNO3 hoặc H2SO4 đặc, nó khử N+5 và S+6 xuống mức oxi hóa thấp hơn.
Ví dụ: 3Zn + HNO3 → 3ZnSO4 + 2NO + 4H2O
Trong đó, HNO3 loãng và NO được tạo ra dưới dạng khí.
+ Phản ứng với nước
Phản ứng này áp dụng cho kim loại nhóm IA và IIA. Sản phẩm tạo thành gồm dung dịch kiềm và khí hydro.
Ví dụ: 2Na + 2H2O → 2NaOH + H2 (khí)
+ Phản ứng với dung dịch muối
Kim loại mạnh có khả năng khử ion kim loại yếu hơn trong muối thành kim loại tự do. Kết quả của phản ứng là một muối mới và kim loại mới.
Ví dụ: Fe + CuSO4 → FeSO4 + Cu
