1. Dung dịch nào có pH lớn hơn 7?
Dung dịch có pH lớn hơn 7 thuộc loại bazơ. Bazơ là hợp chất có một nguyên tử kim loại kết hợp với một hoặc nhiều nhóm OH (Hydroxit), trong đó số nhóm OH tương ứng với hóa trị của kim loại.
Theo tính chất hóa học, bazơ có thể được phân loại thành:
- Bazơ mạnh bao gồm: KOH, NaOH,...
- Bazơ yếu như: Al(OH)3, Fe(OH)3,...
Dựa vào khả năng tan của bazơ trong nước, chúng được phân thành 2 loại:
- Bazơ tan trong nước tạo thành kiềm, chẳng hạn như: NaOH, KOH, LiOH, RbOH, Ba(OH)2, Ca(OH)2, CsOH, Sr(OH)2.
- Bazơ không tan bao gồm: Mg(OH)2, Fe(OH)3, Cu(OH)2, Al(OH)3,…
Cách đặt tên cho bazơ như sau:
Tên bazơ = Tên kim loại (kèm theo hóa trị nếu kim loại có nhiều hóa trị) + hydroxit
Ví dụ:
+ NaOH: Natri hydroxit
+ Ca(OH)2: Canxi hydroxit
+ Cu(OH)2: Đồng (II) hydroxit
+ Fe(OH)2: Sắt (II) hydroxit
Dưới đây là những đặc điểm vật lý nổi bật của bazơ:
Bazơ có tính chất nhờn tương tự như xà phòng.
Chúng có mùi đặc trưng và vị đắng.
Khi các chất này có mặt ở nồng độ cao, chúng có khả năng ăn mòn các hợp chất hữu cơ và tác động mạnh với các axit.
Bazơ kiềm có chỉ số pH lớn hơn 7.
Chúng có thể tồn tại dưới dạng rắn, bột, hoặc thậm chí trong dung dịch.
Các đặc điểm hóa học sau đây cho thấy bazo có sự khác biệt và được ứng dụng rộng rãi trong nhiều lĩnh vực sản xuất và đời sống hiện nay.
Thay đổi màu sắc của giấy quỳ tím và dung dịch phenolphthalein
Khi nhỏ vài giọt dung dịch bazơ (NaOH) lên giấy quỳ tím, màu giấy sẽ chuyển từ tím sang xanh. Điều này cho thấy dung dịch bazơ có khả năng làm đổi màu giấy quỳ tím thành xanh. Do đó, giấy quỳ tím có thể được sử dụng để nhận diện dung dịch bazơ.
Ngoài ra, dung dịch bazơ cũng có khả năng làm dung dịch phenolphthalein từ không màu chuyển thành màu đỏ.
Bazơ phản ứng với oxit axit để tạo thành muối và nước
Dưới đây là phương trình phản ứng:
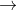
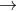
Bazơ phản ứng với axit để tạo ra muối và nước
Dưới đây là phương trình của phản ứng:
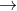
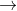
Khi bazơ phản ứng với muối, sẽ tạo ra muối mới và bazơ mới
Phương trình phản ứng như sau:
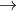
Bazơ (không tan) khi bị đun nóng sẽ phân hủy thành oxit và nước
Dưới đây là phương trình phản ứng:
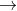
2. Bài tập tổng hợp liên quan đến bazơ
Câu 1. Dãy nào sau đây là các muối axit?
A. NaHSO4, NaHSO3, K2HPO3, KHCO3.
B. KHS, NaHS, KH2PO3, NaH2PO4.
C. NaHS, KHS, Na2HPO3, Na2HPO4.
D. NaHCO3, KHSO3, K3PO4, NaH2PO4.
Câu 2. Dãy nào dưới đây chỉ bao gồm các muối trung hòa?
A. NaCl, MgSO4, Fe(NO3)3.
B. NaHCO3, MgCO3, BaCO3.
C. NaOH, ZnCl2, FeCl2.
D. NaCl, HNO3, BaSO4.
Câu 3. Dãy nào dưới đây chỉ chứa các muối trung hòa?
A. NaOH, NaCl, Na2SO4
B. Zn(NO3)2, FeS, CuSO3
C. NaHS, K3PO4, KCl
D. H2SO4, NaCl, BaCO3
Câu 4. Dung dịch nào dưới đây có pH nhỏ hơn 7?
A. KOH
B. Na2SO4
C. HNO3
D. Ba(OH)2
Câu 5. Dung dịch muối nào dưới đây có pH bằng 7?
A. Al2(SO4)3
B. NH4Cl
C. KNO3
D. Tất cả các dung dịch trên
Câu 6. Muối nào dưới đây khi thủy phân sẽ tạo ra dung dịch có pH nhỏ hơn 7?
A. BaCl2.
B. CH3COOK.
C. NaCl.
D. NH4NO3.
Câu 7. Dung dịch muối nào dưới đây có pH lớn hơn 7?
A. NaNO3.
B. Na2CO3.
C. Ba(NO3)2.
D. NH4Cl.
Câu 8. Chất nào dưới đây khi hòa vào nước không làm thay đổi độ pH của dung dịch?
A. Na2CO3.
B. Na2SO4.
C. HCl.
D. NH4Cl.
Câu 9. Hãy chọn phát biểu chính xác trong số các phát biểu sau đây?
A. Khi giá trị pH tăng, độ axit giảm.
B. Khi giá trị pH tăng, độ axit cũng tăng
C. Dung dịch có pH nhỏ hơn 7 sẽ làm quỳ tím chuyển sang màu xanh
D. Dung dịch có pH lớn hơn 7 sẽ làm quỳ tím chuyển sang màu đỏ
Câu 10. Với các dung dịch: NaHSO4, AlCl3, Na2SO4, K2S, Ca(NO3)2. Số lượng dung dịch có pH nhỏ hơn 7 là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 11. Trong số các hóa chất: Na2S, NaCl, AgNO3, Na2CO3. Hóa chất nào có thể dùng để phân biệt các dung dịch này?
A. Dung dịch NaOH.
B. Dung dịch H2SO4.
C. Dung dịch HCl.
D. Phenolphtalein.
Câu 12. Dựa vào sơ đồ sau: muối A + HCl → muối B + H2S. Dãy nào dưới đây có thể là chất A?
A. BaS, FeS, PbS, K2S.
B. KHS, Ag2S, FeS, Na2S.
C. Na2S, CuS, FeS, MgS.
D. NaHS, ZnS, FeS, MgS.
Câu 13. Với ba dung dịch có cùng giá trị pH, thứ tự các dung dịch theo nồng độ mol tăng dần là:
A. NH3, NaOH, Ba(OH)2
B. NH3, Ba(OH)2, NaOH
C. NaOH, NH3, Ba(OH)2
D. Ba(OH)2, NaOH, NH3
Câu 14. Dãy nào dưới đây có môi trường bazơ (pH lớn hơn 7)?
A. Na2CO3, NaOH, NH4NO3, Na2S.
B. Na2CO3, NH4NO3, KOH, Ba(OH)2.
C. Na2CO3, Na2S, NaClO, NaOH.
D. LiOH, NaOH, Ba(OH)2, HNO3.
Câu 15. Chất nào dưới đây có thể phản ứng với cả dung dịch HCl và dung dịch NaOH?
A. Na2CO3
B. NH4Cl
C. NH3
D. NaHCO3
3. Giải đáp các bài tập thực hành về bazơ
Câu 1:
Đáp án B
Muối axit là loại muối có khả năng phân li ion H+ từ anion gốc axit.
A. Sai vì K2HPO3 là muối trung hòa, dù có H trong cấu trúc nhưng không thể giải phóng H+.
C. Sai vì Na2HPO3 cũng là muối trung hòa.
D. Sai vì K3PO4 là muối trung hòa
Câu 2:
Đáp án A
Muối trung hòa là loại muối mà anion gốc axit không còn nguyên tử hiđro có thể thay thế bởi nguyên tử kim loại.
=> Các muối trung hòa bao gồm: NaCl, MgSO4, Fe(NO3)3.
Loại B vì NaHCO3 là muối axit
Loại C vì NaOH là một bazơ chứ không phải muối
Loại D vì HNO3 là axit, không phải muối
Câu 3:
Đáp án B
Muối trung hòa là muối mà gốc axit không còn nguyên tử hiđro có khả năng thay thế bằng nguyên tử kim loại.
Vì vậy, dãy các chất thỏa mãn là: Zn(NO3)2, FeS, CuSO3
Các đáp án còn lại bị loại vì:
+) NaHS là muối axit
+) H2SO4 là axit
+) NaOH là bazơ
Câu 4:
Đáp án C
Dung dịch nào dưới đây có pH nhỏ hơn 7?
Loại A vì KOH là bazơ, nên pH lớn hơn 7
Loại B vì Na2SO4 được tạo ra từ bazơ mạnh NaOH và axit mạnh H2SO4, nên dung dịch có pH bằng 7
Đúng C vì HNO3 là axit mạnh nên pH nhỏ hơn 7
Loại D vì Ba(OH)2 là bazơ mạnh, do đó pH lớn hơn 7
Câu 5:
Đáp án C
Muối nào dưới đây có pH bằng 7?
Loại A vì Al2(SO4)3 được tạo thành từ bazơ yếu Al(OH)3 và axit mạnh H2SO4, dẫn đến môi trường axit nên pH nhỏ hơn 7
Loại B vì NH4Cl tạo môi trường axit, pH nhỏ hơn 7
Đúng C vì KNO3 được tạo từ bazơ mạnh KOH và axit mạnh HNO3, nên môi trường trung hòa và pH bằng 7
Câu 6:
Đáp án D
Cách xác định môi trường của dung dịch muối:
+ Muối được hình thành từ axit mạnh và bazơ yếu sẽ có môi trường axit (pH < 7)
+ Muối được hình thành từ axit yếu và bazơ mạnh sẽ có môi trường kiềm (pH > 7)
+ Muối được hình thành từ axit mạnh và bazơ mạnh sẽ có môi trường trung tính (pH = 7)
NH4NO3 là muối của bazơ yếu (NH3) và axit mạnh (HNO3)
=> Khi thủy phân trong nước, sẽ tạo ra môi trường có tính axit (pH < 7)
Câu 7:
Đáp án B: Na2CO3 là muối của bazơ mạnh (NaOH) và axit yếu (H2CO3)
Câu 8:
Đáp án B
A. Na2CO3 được tạo thành từ bazơ mạnh NaOH và axit yếu H2CO3, do đó có tính bazơ, làm pH tăng
B. Na2SO4 hình thành từ bazơ mạnh NaOH và axit mạnh H2SO4, nên môi trường là trung tính và không làm pH thay đổi
C. HCl tạo môi trường axit, làm giảm pH
D. NH4Cl là muối của bazơ yếu NH3 và axit mạnh HCl, tạo môi trường axit, làm giảm pH
Câu 9:
Đáp án A
A đúng vì khi pH tăng, nồng độ OH- trong dung dịch cũng tăng, dẫn đến giảm tính axit
C. Khi pH < 7, môi trường là axit, quỳ tím sẽ chuyển sang màu đỏ
D. Khi pH > 7, môi trường là bazơ, quỳ tím sẽ chuyển sang màu xanh
Câu 10:
Đáp án B
NaHSO4 có khả năng giải phóng ion H+ ⟹ Môi trường axit ⟹ pH < 7.
+ AlCl3 là muối từ bazơ yếu Al(OH)3 và axit mạnh HCl ⟹ Môi trường axit ⟹ pH < 7.
+ Na2SO4 là muối từ bazơ mạnh NaOH và axit mạnh H2SO4 ⟹ Môi trường trung tính ⟹ pH = 7.
+ K2S là muối từ bazơ mạnh KOH và axit yếu H2S ⟹ Môi trường kiềm ⟹ pH > 7.
+ Ca(NO3)2 là muối từ bazơ mạnh Ca(OH)2 và axit mạnh HNO3 ⟹ Môi trường trung tính ⟹ pH = 7.
Câu 11:
Đáp án A
Dùng dung dịch HCl để phân biệt 4 hóa chất trên
Lấy mẫu và đánh số thứ tự
Nhỏ dung dịch HCl vào 4 ống nghiệm chứa các hóa chất khác nhau
Ống nghiệm nào xuất hiện kết tủa trắng thì hóa chất ban đầu là AgNO3
Phản ứng: AgNO3 + HCl → AgCl↓ + HNO3
Ống nghiệm nào xuất hiện khí có mùi trứng thối thì hóa chất ban đầu là Na2S
Phản ứng: Na2S + 2HCl → 2NaCl + H2S
Ống nghiệm nào phát sinh khí không màu là Na2CO3
Phản ứng: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Những mẫu thử khác không có phản ứng gì
Câu 12:
Đáp án D
+ Loại A: Hòa tan trong nước và axit mạnh, tạo ra khí H2S bao gồm các hợp chất Na2S, K2S, CaS, BaS và (NH4)2S.
Phản ứng: Na2S + 2HCl → 2NaCl + H2S↑
+ Loại B: Không tan trong nước nhưng hòa tan trong axit mạnh, ví dụ như FeS, ZnS,...
Phản ứng: ZnS + 2H2SO4 → ZnSO4 + H2S↑
+ Loại C: Không tan trong nước và không tan trong axit, bao gồm CuS, PbS, HgS, Ag2S,...
Câu hỏi số 13:
Lựa chọn D
pH tương đương => Nồng độ mol của ion OH- trong các dung dịch là như nhau
Phương trình phân ly:
Ba(OH)2 → 2OH-
NaOH → ion OH-
NH3 + H2O ⇔ NH4+ + ion OH-
Vì [OH-] giống nhau => [Ba(OH)2] < [NaOH] < [NH3]
Câu hỏi số 14:
Lựa chọn C
A và B bị loại vì NH4NO3 được hình thành từ bazơ yếu (NH3) và axit mạnh (HNO3), tạo môi trường axit
D loại HNO3
Câu hỏi số 15:
Lựa chọn D
