Enzyme (hay còn gọi là enzym tiêu hóa) là các protein có tác dụng như chất xúc tác sinh học. Chúng thúc đẩy các phản ứng hóa học. Các phân tử được enzym tác động gọi là chất xúc tác, và sản phẩm được hình thành từ các chất xúc tác là các phân tử khác nhau. Hầu hết các quá trình trao đổi chất trong tế bào đều phụ thuộc vào sự xúc tác của enzym để diễn ra với tốc độ đủ để duy trì sự sống. Đường trao đổi chất phụ thuộc vào các enzym để tiến hành từng bước. Ngành nghiên cứu về enzym gọi là enzym học, và lĩnh vực phân tích enzym đang phát triển mạnh mẽ. Trong quá trình tiến hóa enzym, một số enzym đã mất đi khả năng xúc tác sinh học, phản ánh qua chuỗi amino acid và tính chất xúc tác 'giả' của chúng.
Enzyme là chất xúc tác trong hơn 5.000 loại phản ứng hóa sinh. Các chất xúc tác sinh học khác được tạo thành từ phân tử RNA được gọi là ribozym. Sự lựa chọn của enzym phụ thuộc vào cấu trúc bậc 3 của chúng.
Giống như các loại xúc tác khác, enzyme gia tăng tốc độ phản ứng bằng cách giảm năng lượng hoạt hóa. Một số enzym có khả năng gia tăng tốc độ phản ứng lên đến hàng triệu lần. Một ví dụ điển hình là orotidine 5'-phosphate decarboxylase; nó có khả năng kích hoạt một phản ứng kéo dài hàng triệu năm chỉ trong vài mili giây. Về mặt hóa học, enzym giống như các chất xúc tác khác là không bị tiêu thụ trong các phản ứng hóa học và không làm thay đổi sự cân bằng hóa học. Sự khác biệt của enzym so với các chất xúc tác khác là sự lựa chọn cao. Hoạt động của enzym có thể bị ảnh hưởng bởi các phân tử khác như chất ức chế enzym và chất hoạt hóa enzym. Nhiều thuốc và chất độc thực tế là các chất ức chế enzym. Hiệu suất của enzym giảm đáng kể nếu nhiệt độ và pH không đạt mức tối ưu. Khi nhiệt độ quá cao, nhiều enzym có thể bị biến đổi làm mất đi cấu trúc và tính chất xúc tác của chúng.
Một số enzym đã được thương mại hóa, ví dụ như trong quá trình sản xuất chất kháng sinh. Một số sản phẩm gia đình có chứa enzym để gia tăng tốc độ các phản ứng hóa học. Ví dụ: bột giặt có chứa enzym giúp phân hủy protein, tinh bột hoặc chất béo trên quần áo; enzym trong papain giúp phân hủy protein thành các phân tử nhỏ hơn, làm cho thịt mềm và dễ nhai hơn.
Lịch sử

Từ cuối thế kỷ 17 và đầu thế kỷ 18, việc tiêu hóa thịt bằng các chất tiết từ dạ dày và sự chuyển hóa tinh bột thành đường bởi các chất tiết từ thực vật và nước bọt đã được biết đến. Tuy nhiên, cơ chế của các quá trình này vẫn chưa được xác định rõ ràng.
Năm 1833, nhà hóa học người Pháp Anselme Payen đã phát hiện ra enzym đầu tiên, diastase. Một vài thập kỷ sau đó, trong khi nghiên cứu quá trình lên men đường thành rượu bằng nấm men, Louis Pasteur đã kết luận rằng quá trình lên men được xúc tác bởi một yếu tố quan trọng có trong tế bào nấm men gọi là 'ferments', mà ông cho rằng chỉ tồn tại trong sinh vật sống. Ông viết rằng 'quá trình lên men rượu là một phản ứng liên quan đến sự sống và cấu trúc của tế bào nấm men, chứ không phải là các tế bào đã chết.
Năm 1877, nhà vật lý học người Đức Wilhelm Kühne đã sử dụng thuật ngữ enzyme, từ tiếng Hy Lạp là ενζυμον, có nghĩa là 'trong men', để mô tả quá trình này.
Năm 1897, Eduard Buchner đã công bố bài báo đầu tiên về khả năng chiết xuất men từ các tế bào nấm men còn sống để lên men đường. Trong một thí nghiệm tại Đại học Berlin, ông nhận thấy rằng đường có thể lên men ngay cả khi không có tế bào nấm men trong hỗn hợp. Ông đặt tên cho enzym lên men sucrose là 'zymase'. Năm 1907, ông đã nhận giải Nobel hóa học 'cho nghiên cứu sinh hóa và phát hiện của ông về quá trình lên men không có tế bào'.
Danh pháp
Một enzyme thông thường thường có tên gọi là 'tên chất xúc tác' kết hợp với hậu tố -ase (một số nguồn Việt phiên âm thành -aza) như lactase (phân hủy lactose), maltase (phân hủy maltose)... Hoặc có thể là tên của phản ứng + -ase như RNA polymerase có vai trò xúc tác hình thành liên kết phosphodiester giữa các nucleotide RNA tự do để tạo thành chuỗi phân tử RNA (ribonucleic acid) (tức là RNA polymerase xúc tác cho quá trình trùng hợp 'monomer' nucleotide thành chuỗi 'polymer' RNA). Ngoài ra, cũng có những enzyme không có hậu tố -ase nhưng vẫn mang ý nghĩa cho phản ứng mà chúng xúc tác như pepsin (enzyme có ở dạ dày, có vai trò cắt protein thành các chuỗi polypeptide ngắn hơn). Theodor Schwann (người đầu tiên phát hiện ra enzyme này) đặt tên là 'pepsin' dựa trên từ gốc Hy Lạp πέψις pepsis có nghĩa là 'tiêu hóa', hay papain là một enzyme được tìm thấy trong quả đu đủ (Vasconcellea pubescens, tiếng Anh: papaya) với hoạt tính protease...
Phân loại và cấu trúc
Phân loại quốc tế
Liên đoàn Quốc tế về Hóa sinh và Sinh học phân tử (IUBMB) đã phát triển hệ thống danh pháp đặc biệt cho enzyme, gọi là chỉ số EC (Enzyme Commission number). EC bao gồm 'EC' và số chỉ ra loại phản ứng mà enzyme tham gia xúc tác. Để tổng quát hóa các loại enzyme theo vai trò xúc tác, người ta chia thành 06 lớp.
| Lớp | Tên | Vai trò xúc tác | Ví dụ |
|---|---|---|---|
| EC 1 | Oxyoreductase | Xúc tác các phản ứng oxy hóa - khử | Alcohol oxidoreductase, CH-CH oxidoreductases, Peroxidase |
| EC 2 | Transferase | Vận chuyển các nhóm chức từ cơ chất này sang cơ chất khác | Methyltransferase, Phosphotransferase, Acyltransferase |
| EC 3 | Hydrolase | Xúc tác sự đứt gãy các liên kết hóa học từ phản ứng thủy phân | Glycoside hydroxylase, Nuclease, Protease |
| EC 4 | Lyase | Xúc tác sự nối thêm một chất mới vào cơ chất bằng cách làm gãy nối đôi. Ngược lại, chúng có thể xúc tác tạo nối đôi. Lyase không xúc tác phản ứng thủy phân hay oxy hóa. | Aldehyde lyase, Adenylyl cyclase, Guanylate cyclase |
| EC 5 | Isomerase | Xúc tác sự tái phân bố các nguyên tử trong cơ chất, tức biến đổi đồng phân này thành đồng phân khác (isomerization) | Maleate isomerase, Furylfuramide isomerase, Triose-phosphate isomerase |
| EC 6 | Ligase | Xúc tác hình thành liên kết hóa học mới có sử dụng năng lượng từ adenosine triphosphate (ATP) | Argininosuccinate synthase, Chelatase, DNA ligase |
| EC 7 | Translocases | Vận chuyển phân tử xuyên qua màng tế bào | ATP synthase, PEP carbonxylase |
Thành phần cấu tạo
Enzyme là protein nên cấu trúc không gian thường có dạng bậc ba, bậc bốn. Enzyme có hai dạng cơ bản:
- Enzyme đơn thành phần chỉ bao gồm protein.
- Enzyme đa thành phần là phức hợp protein (protein complex) bao gồm hai thành phần chính là protein (gọi là apoenzyme) và thành phần phi protein (gọi là cofactor) như ion kim loại (Fe, Mg, I), hợp chất hữu cơ (coenzyme) như vitamin (retinol, thiamin, pyridoxine, folate, ascorbic acid...), glutathione (GSH), ubiquinone (Coenzyme Q, CoQ), S-Adenosylmethionine (SAM)...
Vì enzyme là protein, nên khi gặp điều kiện môi trường như nhiệt độ, pH... không thuận lợi hoặc tiếp xúc với các tác nhân gây biến tính hóa học như natri dodecyl sulfat (SDS), formaldehyde, picric acid... sẽ xảy ra hiện tượng biến tính (denaturation): các liên kết yếu trong phân tử như liên kết ion, tương tác Van der Waals, tương tác kị nước... bị phá vỡ, d导致polypeptide dãn ra thành cấu trúc bậc một (hoặc bậc hai), làm mất cấu trúc ban đầu của enzyme và do đó enzyme mất chức năng. Trong một số trường hợp ít, khi điều kiện môi trường thuận lợi trở lại, polypeptide có thể cuộn gập lại và khôi phục cấu trúc ban đầu, từ đó khôi phục chức năng. Đây được gọi là hiện tượng hồi tính (renaturation).
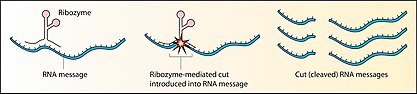
Ngoài ra, một số phân tử RNA có hoạt tính xúc tác tương tự như enzyme, được gọi là ribozyme. Chúng có cấu trúc mạch đơn nên có thể tự cuộn gập thành cấu trúc không gian đặc trưng để xúc tác hoặc kết hợp với nucleic acid hoặc protein khác để tạo ra cấu trúc không gian phù hợp với nhiệm vụ xúc tác. Bên cạnh đó, vì là mạch đơn, một số base chứa nhóm nguyên tử có thể tham gia trực tiếp vào phản ứng. Một số ribozyme tiêu biểu là ribozyme tự cắt nối intron (intron self-splicing, có cofactor là Mn) thuộc nhóm I và II, ribozyme của virus HDV (gây bệnh viêm gan), viroid...
Cơ chế hoạt động
Cấu trúc chung
Mọi enzyme đều có một trung tâm hoạt động (active site) - đây là vùng protein quan trọng nhất của enzyme. Nếu có lỗi đột biến, thay đổi ngẫu nhiên hay lệch khung đọc mở (reading-open frame)... trong các triplet mã hóa cho amino acid ở vùng này, enzyme có thể mất chức năng. Trung tâm hoạt động bao gồm vị trí liên kết (binding site) với cơ chất và vị trí xúc tác (catalytic site) - nơi diễn ra phản ứng xúc tác.
Enzyme cũng có domain điều hòa (regulation site), nơi mà các chất ức chế không cạnh tranh (uncompetitive inhibitor) hoặc các chất điều hòa dị lập thể kết hợp. Domain điều hòa còn được biết đến như là miền điều hòa dị lập thể (Allosteric site).
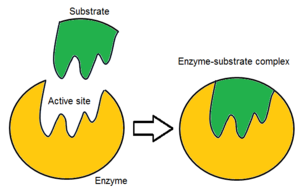
Cơ chế tiếp nhận cơ chất
Mô hình Fischer
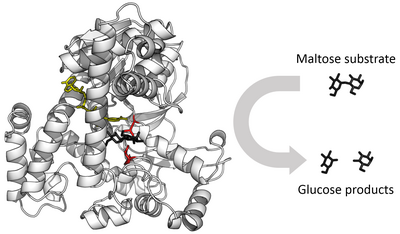
Người ta nhận thấy, cơ chất (substrate) sẽ liên kết với enzyme đặc hiệu để tham gia phản ứng đặc trưng tương ứng. Ví dụ: đường sucrose chỉ có thể do enzyme sucrase xúc tác thủy phân thành hai monosaccharide tương ứng là đường glucose và đường fructose; hay chất truyền tin trung gian acetylcholine bị phân hủy bởi enzyme acetylcholinesterase để tạo thành acetyl và choline... Để giải thích cho sự đặc hiệu này, Emil Fischer đã đề xuất giả thuyết 'ổ khóa - chìa khóa' vào năm 1894. Enzyme có vai trò giống 'ổ khóa' thể hiện qua vị trí liên kết có cấu trúc đặc hiệu mà chỉ có cơ chất đặc hiệu (đóng vai trò 'chìa khóa') có cấu trúc không gian khớp với miền hoạt động của enzyme. Thuyết này có thể giải thích tính đặc hiệu của enzyme nhưng không thể giải thích được sự ổn định trạng thái chuyển tiếp mà enzyme có được.
Mô hình Koshland
Năm 1958, Daniel Koshland đã đưa ra một giả thuyết bổ sung cho mô hình Fischer. Ông cho rằng cấu trúc của enzyme rất linh hoạt và đặc biệt là trung tâm hoạt động có thể thay đổi liên tục để phù hợp tối đa với cơ chất. Do đó, cơ chất có thể kết nối với enzyme một cách hiệu quả nhất để các phản ứng xúc tác diễn ra. Đôi khi, các phân tử cơ chất có thể thay đổi một chút về cấu trúc để tăng hiệu quả xúc tác, như trong trường hợp của glycoside hydrolase.
Cơ chế hoạt động của enzyme
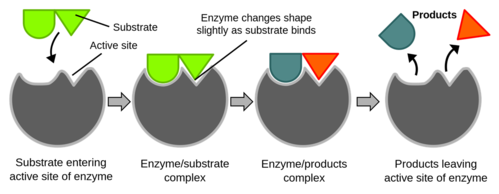
Cơ chế hoạt động của enzyme gồm ba bước chính:
- Cơ chất (Substrate) kết hợp với enzyme (Enzyme) để tạo thành phức hợp enzyme - cơ chất (E - S complex).
- Enzyme thúc đẩy phản ứng biến đổi cơ chất thành sản phẩm (Product), tạo thành phức hợp E-P.
- Sản phẩm P được giải phóng từ enzyme E.
Cơ chế tổng quát của enzyme
Thông thường, để một phản ứng xảy ra, cần cung cấp một lượng năng lượng hoạt hóa EA nhất định để đạt đến trạng thái chuyển tiếp. Năng lượng hoạt hóa ảnh hưởng đến tốc độ của phản ứng. Ví dụ, xét phản ứng:
Tốc độ phản ứng hóa học v được định nghĩa là tốc độ mất dần của chất phản ứng theo thời gian để hình thành sản phẩm. Theo phương trình này, ta có:
Ở đây [A], [B] là nồng độ mol/l của chất phản ứng A, B và k là hằng số tốc độ phản ứng. Hằng số k có thể được tính theo phương trình Arrhenius:
Ở đây: A là tần số va chạm, Ea là năng lượng hoạt hóa (J), R là hằng số khí, T là nhiệt độ tuyệt đối (K). Biến đổi phương trình trên, ta thu được . Vì vậy, khi Ea càng lớn, hằng số k càng nhỏ và tốc độ phản ứng v cũng càng chậm. Do đó, để tăng tốc độ phản ứng, cơ chế tác chung của enzyme giúp giảm năng lượng hoạt hóa thông qua nhiều phương pháp khác nhau:
- Enzyme hành động như một khuôn mẫu để hướng dẫn các quá trình hóa học của cơ chất.
- Enzyme gây tác động lên cơ chất và giữ vững trạng thái chuyển tiếp.
- Vùng hoạt động của enzyme cung cấp môi trường lý tưởng cho phản ứng diễn ra.
- Vùng hoạt động của enzyme tham gia trực tiếp vào phản ứng xúc tác. Sau khi phản ứng kết thúc, vùng này có thể được tái sử dụng để tham gia các phản ứng xúc tác khác.
