


| Ethan | |
|---|---|
Cấu trúc phân tử của Ethan | |
| Tổng quan | |
| Danh pháp IUPAC | Ethan |
| Tên khác | đimetyl etyl hydride methylmethan |
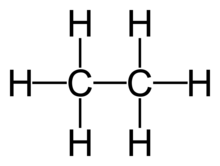
| Công thức phân tử | C2H6 |
| Phân tử gam | 30,07 g/mol |
| Biểu hiện | Chất khí không màu |
| Số CAS | [74-84-0] |
| Thuộc tính | |
| Tỷ trọng và pha | 0,548 g/cm³, khí |
| Độ hòa tan trong nước | 4,7 g/100 ml |
| Nhiệt độ nóng chảy | -182,76 °C (90,34 K) |
| Điểm sôi | -88,6 °C (184,5 K) |
| pKa | 50 |
| pKb | ? |
| Độ nhớt | ? cP ở 20 °C |
| Khác | |
| MSDS | MSDS ngoài |
| Các nguy hiểm chính | Dễ bắt cháy (F+) |
| NFPA 704 | |
| Điểm bắt lửa | 135 °C |
| Rủi ro/An toàn | R: 12 S: 2, 9, 16, 33 |
| Số RTECS | KH3800000 |
| Dữ liệu hóa chất bổ sung | |
| Cấu trúc & thuộc tính | n εr, v.v. |
| Dữ liệu nhiệt động lực | Các trạng thái rắn, lỏng, khí |
| Dữ liệu quang phổ | UV, IR, NMR, MS |
| Các hợp chất liên quan | |
| Các hợp chất tương tự | methan propan |
| Các hợp chất liên quan | ethanol |
| Ngoại trừ có thông báo khác, các dữ liệu được lấy ở 25 °C, 100 kPa Thông tin về sự phủ nhận và tham chiếu | |
Ethan là một hợp chất hóa học với công thức C2H6. Đây là một alkan, tức là một hydrocarbon no không vòng. Dưới điều kiện áp suất và nhiệt độ bình thường, ethan là một khí không màu và không có mùi. Nó là hydrocarbon bão hòa đơn giản nhất có hơn một nguyên tử carbon. Ethan có vai trò quan trọng trong công nghiệp vì có thể chuyển hóa thành etylen qua quá trình cracking. Trong công nghiệp, ethan thường được chiết xuất từ khí tự nhiên hoặc qua chưng cất dầu mỏ. Trong phòng thí nghiệm, ethan có thể được tổng hợp qua phương pháp điện phân Kolbe.
Tính chất hóa học
Khi được đun nóng ở 500 °C với sự hiện diện của xúc tác, ethan chuyển hóa thành ethylen: C2H6 -> C2H4 + H2
Phản ứng với halogen:
Ví dụ: C2H6 + Br2 -> C2H5Br + HBr
Phản ứng với HNO3: C2H6 + HNO3 (40-60 °C) -> C2H5O2N + H2O
Phương pháp điều chế
- 2CH3Cl + 2Na → C2H6 + 2NaCl
Phương trình tổng quát:
- 2RCl + 2Na → R + 2NaCl
- 3CH3Cl + 3 C2H5Cl + 6Na → C2H6 + C4H10 + C3H8 + 6NaCl
- C2H4 + H2 → C2H6
Phương trình tổng quát:
- CnH2n + H2 → CnH2n+2
- C4H10 → C2H6 + C2H4
- C2H5COONa + NaOH → C2H6 + Na2CO3
Phương trình chung:
- RCOONa + NaOH → RH + Na2CO3
- C2H2 + 2H2 → C2H6
Phương trình tổng quát:
- CnH2n-2 + 2H2 → CnH2n+2
Ứng dụng
Ethan là nguyên liệu quan trọng trong ngành công nghiệp hóa dầu và đóng vai trò then chốt trong nền kinh tế toàn cầu. Nguyên liệu đầu vào chủ yếu là khí thiên nhiên và dầu thô. Dầu thô được xử lý tại các nhà máy lọc dầu qua phương pháp chưng cất phân đoạn và sau đó được chế biến thành các sản phẩm khác như xăng. Phân đoạn dầu thô có các điểm sôi khác nhau, giúp tách biệt và cô lập các thành phần một cách dễ dàng: các chất có điểm sôi gần nhau sẽ bay hơi cùng một lúc. Mỗi alkan có thể được sử dụng cho mục đích cụ thể dựa trên số nguyên tử carbon của nó, mặc dù phân chia này chỉ là lý tưởng hóa. Bốn alkan đầu tiên thường được dùng để cung cấp nhiệt cho sưởi ấm và nấu ăn, hoặc trong một số quốc gia để chạy máy phát điện. Methan và ethan là thành phần chính của khí thiên nhiên, thường được lưu trữ dưới dạng khí nén, nhưng có thể dễ dàng chuyển thành dạng lỏng bằng cách nén và làm lạnh đồng thời. Propan và butan có thể hóa lỏng ở áp suất tương đối thấp và được gọi là khí hóa lỏng (LPG). Propan được sử dụng trong lò nung khí propan, trong khi butan thường thấy trong bật lửa sử dụng một lần (áp suất khoảng 2 bar). Cả hai alkan này cũng được dùng làm tác nhân đẩy trong bình xịt. Từ pentan đến octan, các alkan là chất lỏng dễ bay hơi, được dùng làm nhiên liệu cho động cơ đốt trong vì chúng dễ bay hơi mà không tạo giọt nhỏ gây hỏng sự cháy. Các alkan mạch nhánh được ưa chuộng hơn vì có điểm bắt cháy muộn hơn so với alkan mạch thẳng, giảm tiếng nổ trong động cơ và bảo vệ động cơ. Chỉ số octan đo xu hướng bắt cháy sớm của nhiên liệu, với 2,2,4-trimethylpentan (isooctan) có chỉ số 100 và heptan là 0. Các alkan này cũng là dung môi tốt cho các chất không phân cực. Alkan từ nonan trở lên, chẳng hạn như hexadecan (alkan với 16 nguyên tử carbon), là chất lỏng nhớt cao và không phù hợp làm xăng. Thay vào đó, chúng là thành phần chính của dầu diesel và nhiên liệu hàng không. Dầu diesel được đánh giá theo chỉ số cethan (cethan là tên cũ của hexadecan). Tuy nhiên, điểm nóng chảy cao của các alkan này có thể gây vấn đề ở nhiệt độ thấp và vùng gần cực, làm cho nhiên liệu trở nên đặc và khó truyền dẫn.
Các alkan từ hexadecan trở lên tạo thành thành phần chính của nhiên liệu trong lò đốt và dầu bôi trơn. Trong vai trò dầu bôi trơn, chúng hoạt động như chất chống gỉ nhờ tính không ưa nước, ngăn nước tiếp xúc với bề mặt kim loại. Nhiều alkan rắn được sử dụng như parafin, ví dụ như trong nến. Paraffin không nên nhầm lẫn với sáp thực sự (như sáp ong), chủ yếu là hỗn hợp ester. Các alkan với mạch carbon từ 35 trở lên thường được tìm thấy trong bitum, chủ yếu được sử dụng trong nhựa đường để rải đường. Tuy nhiên, các alkan có mạch carbon dài ít có giá trị thương mại và thường được phân tách thành các alkan mạch ngắn hơn qua phương pháp cracking.
- Diboran
- Disilan
Các liên kết ngoài
- Thẻ an toàn hóa chất quốc tế số 0266
- Ủy ban hóa chất châu Âu (ECB) Lưu trữ ngày 22 tháng 7 năm 2011 trên Wayback Machine
- Hóa điện toán tại Wikipedia
Alkan |
|---|
Hydrocarbon |
|---|
