
| Ethylen | |||
|---|---|---|---|
|
| |||
| Danh pháp IUPAC | Ethylene | ||
| Nhận dạng | |||
| Số CAS | 74-85-1 | ||
| PubChem | 6325 | ||
| KEGG | C06547 | ||
| ChEBI | 18153 | ||
| ChEMBL | 117822 | ||
| Số RTECS | KU5340000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ | ||
| InChI | đầy đủ | ||
| Tham chiếu Beilstein | 1730731 | ||
| Tham chiếu Gmelin | 214 | ||
| UNII | 91GW059KN7 | ||
| Thuộc tính | |||
| Công thức phân tử | C 2H 4 | ||
| Bề ngoài | colorless gas | ||
| Khối lượng riêng | 1.178 kg/m³ at 15 °C, gas | ||
| Điểm nóng chảy | −169,2 °C (104,0 K; −272,6 °F) | ||
| Điểm sôi | −103,7 °C (169,5 K; −154,7 °F) | ||
| Độ hòa tan trong nước | 0.131 mg/mL (25 °C); 2.9 mg/L | ||
| Độ hòa tan trong ethanol | 4.22 mg/L | ||
| Độ hòa tan trong diethyl ether | good | ||
| Độ axit (pKa) | 44 | ||
| MagSus | -15.30·10 cm³/mol | ||
| Độ nhớt | 10.28 μPa·s | ||
| Acid liên hợp | Ethenium | ||
| Cấu trúc | |||
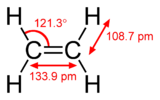
| Hình dạng phân tử | D2h | ||
| Mômen lưỡng cực | zero | ||
| Nhiệt hóa học | |||
| Enthalpy hình thành ΔfH298 | +52.47 kJ/mol | ||
| Entropy mol tiêu chuẩn S298 | 219.32 J·K·mol | ||
| Các nguy hiểm | |||
| NFPA 704 |
4
2
2
| ||
| Ký hiệu GHS | |||
| Báo hiệu GHS | Danger | ||
| Chỉ dẫn nguy hiểm GHS | H220, H336 | ||
| Chỉ dẫn phòng ngừa GHS | P210, P261, P271, P304+P340, P312, P377, P381, P403, P403+P233, P405, P501 | ||
|
| |||
| Các hợp chất liên quan | |||
| Hợp chất liên quan | Ethan Acetylen Propylen | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa).
(cái gì ?)
Tham khảo hộp thông tin | |||
Ethylen, (tiếng Anh: ethylene, tên IUPAC: ethene) có công thức hóa học là C2H4 hoặc H2C=CH2. Đây là hợp chất đầu tiên trong dãy đồng đẳng của alken. Ethylen là một trong những hợp chất hữu cơ được sản xuất nhiều nhất trên thế giới, đạt khoảng 150 triệu tấn vào năm 2016. Hydrat của ethylen là etanol.
Tính chất vật lý
Ethylen là khí không màu, không mùi, nhẹ hơn không khí, ít tan trong nước nhưng dễ hòa tan trong ether và một số dung môi hữu cơ.
Tính chất hóa học
Ethylen có các phản ứng hóa học đặc trưng như phản ứng cháy, phản ứng cộng và phản ứng trùng hợp.
Phản ứng cộng
Phản ứng với halogen:
- C2H4 + Br2 → C2H4Br2
Phản ứng với H2:
- C2H4 + H2 → C2H6
Tác dụng với axit:
- C2H4 + HBr → C2H5Br
Phản ứng trùng hợp
Khi phản ứng với chất xúc tác và nhiệt độ, ethylen tạo ra polyethylen:
- nCH2=CH2 → (-CH2-CH2-)n
Tác dụng với KMnO4
- 3C2H4 + 4H2O + 2KMnO4 → 2KOH + 2MnO2 + 3C2H4(OH)2
Kết quả của phản ứng là kali hydroxit, mangan(IV) oxit và ethylen glycol.
Phản ứng cháy
Khi cháy, ethylen sản sinh ra hơi nước, khí CO2 và giải phóng nhiệt lượng:
- C2H4 + 3O2 → 2CO2 + 2H2O
Ethylen làm mất màu dung dịch brom
Khi dẫn ethylen vào dung dịch brom, dung dịch brom sẽ mất màu:
- Br2 + C2H4 → C2H4Br2
Phản ứng với Cl2, Br2 ở nhiệt độ cao
Ethylen tham gia vào phản ứng thay thế nguyên tử H ở liên kết đôi:
- CH2=CH2 + Cl2 → CH2=CHCl + HCl
Ứng dụng
Ethylen được sử dụng để sản xuất nhựa polyethylen, etanol, acid acetic, và nhiều sản phẩm khác. Ngoài ra, nó còn giúp thúc đẩy quá trình chín của trái cây.
