| Hydro fluoride | |||
|---|---|---|---|
|
| |||
| Tên khác | Fluoran | ||
| Nhận dạng | |||
| Số CAS | 7664-39-3 | ||
| PubChem | 16211014 | ||
| KEGG | C16487 | ||
| ChEBI | 29228 | ||
| Số RTECS | MW7875000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ | ||
| InChI | đầy đủ | ||
| UNII | RGL5YE86CZ | ||
| Thuộc tính | |||
| Công thức phân tử | HF | ||
| Khối lượng mol | 20,00634 g/mol | ||
| Bề ngoài | khí hoặc chất lỏng không màu (dưới 19.5°C) | ||
| Khối lượng riêng | 1,15 g/L, gas (25 °C) 0.99 g/mL, liquid (19.5 °C) | ||
| Điểm nóng chảy | −83,6 °C (189,6 K; −118,5 °F) | ||
| Điểm sôi | 19,5 °C (292,6 K; 67,1 °F) | ||
| Độ hòa tan trong nước | miscible | ||
| Áp suất hơi | 783 mmHg (20 °C) | ||
| Độ axit (pKa) | 3.17 | ||
| Chiết suất (nD) | 1,00001 | ||
| Cấu trúc | |||
| Hình dạng phân tử | Linear | ||
| Mômen lưỡng cực | 1.86 D | ||
| Nhiệt hóa học | |||
| Enthalpy hình thành ΔfH298 | −13,66 kJ/g (gas) −14.99 kJ/g (liquid) | ||
| Entropy mol tiêu chuẩn S298 | 8,687 J/g K (gas) | ||
| Các nguy hiểm | |||
| NFPA 704 |
0
4
1
| ||
| PEL | TWA 3 ppm | ||
| LC50 | 1276 ppm (rat, 1 hr) 1774 ppm (monkey, 1 hr) 4327 ppm (guinea pig, 15 min) | ||
| REL | TWA 3 ppm (2.5 mg/m³) C 6 ppm (5 mg/m³) [15-minute] | ||
| IDLH | 30 ppm | ||
| Các hợp chất liên quan | |||
| Anion khác | Hydro chloride Hydro bromide Hydro iodide Hydrogen astatide | ||
| Cation khác | Natri fluoride Kali fluoride Rubidi fluoride Caesi fluoride | ||
| Hợp chất liên quan | Nước Ammonia | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa).
(cái gì ?)
Tham khảo hộp thông tin | |||
Flohydric là một hợp chất hóa học với công thức hóa học HF. Loại khí hoặc chất lỏng không màu này là nguồn cung cấp fluor chính trong công nghiệp, thường xuất hiện dưới dạng dung dịch nước gọi là axit hydrofluoric. Đây là nguyên liệu quan trọng trong việc tổng hợp nhiều hợp chất thiết yếu như dược phẩm và polymer (ví dụ như Teflon). HF được ứng dụng rộng rãi trong ngành công nghiệp hóa dầu như một thành phần của các chất siêu acid. Flohydric có điểm sôi ở nhiệt độ phòng, cao hơn nhiều so với các hydro halide khác. Không giống như các hydro halide khác, HF nhẹ hơn không khí.
Flohydric là một loại khí nguy hiểm, tạo thành axit hydrofluoric có tính ăn mòn và xâm nhập khi tiếp xúc với độ ẩm. Khí này cũng có thể gây mù do sự hủy hoại nhanh chóng của giác mạc.
Nhà hóa học người Pháp Edmond Frémy (1814-1894) được cho là đã phát hiện ra flohydric khan khi cố gắng tách fluor. Mặc dù Carl Wilhelm Scheele đã chuẩn bị axit hydrofluoric với số lượng lớn vào năm 1771, axit này đã được biết đến trong ngành công nghiệp thủy tinh trước đó.
Cấu trúc
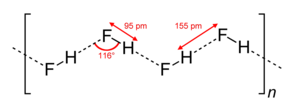
Mặc dù HF là một phân tử diatomic, nó hình thành liên kết hydro liên phân tử tương đối bền. Trong trạng thái rắn, HF tạo thành chuỗi zigzag của các phân tử HF. Những phân tử này, với liên kết H-F dài 95 pm, được kết nối với nhau qua liên kết H-F liên phân tử dài 155 pm. Trong trạng thái lỏng, HF cũng hình thành các chuỗi, nhưng chúng ngắn hơn, chỉ bao gồm trung bình năm hoặc sáu phân tử.
So sánh với các hydro halide khác
Hydro fluoride không sôi cho đến 20°C, trong khi các hydro halide nặng hơn sôi ở nhiệt độ −85°C (−120°F) và −35°C (−30°F). Liên kết hydro giữa các phân tử HF làm tăng độ nhớt trong pha lỏng và giảm áp suất trong pha khí.
Hydro fluoride có thể hòa tan trong nước ở bất kỳ tỷ lệ nào, trong khi các hydro halide khác có khoảng cách hòa tan rất khác biệt với nước. Khi kết hợp với nước, hydro fluoride còn tạo ra một số hợp chất rắn, đặc biệt là hợp chất 1:1 không tan ở -40°C (-40°F), cao hơn điểm nóng chảy của HF nguyên chất là 44°C (79°F).
Độ axit
Khác với các axit halogen khác như axit clohidric, hydro fluoride chỉ là một axit yếu trong dung dịch pha loãng. Điều này không chỉ do sức mạnh của liên kết hydrogen-fluor mà còn do các yếu tố khác như xu hướng của các anion HF, H
2O, và F
tạo thành cụm. Ở nồng độ cao, HF hình thành các ion đa chức năng (như bifluoride, HF-
2) và proton, làm tăng độ axit. Điều này dẫn đến việc proton hóa các axit mạnh như hydrochloric, sulfuric, hoặc nitric khi sử dụng dung dịch axit fluorfluoric tập trung. Dù được xem là axit yếu, axit hydrofluoric rất ăn mòn, thậm chí tấn công cả kính khi có nước.
Độ axit của dung dịch axit hydrofluoric thay đổi theo nồng độ do sự tương tác của liên kết hydro của ion fluoride. Dung dịch pha loãng có độ axit yếu với hằng số ion hóa axit Ka = 6.6x10-4 (hoặc pKa = 3.18), trái ngược với các dung dịch tương ứng của các hydrohalogen khác là axit mạnh (pKa <0). Các dung dịch cô đặc của hydro fluoride có độ axit cao hơn nhiều so với giá trị này, như được thể hiện bằng hàm lượng axit Hammett H0 (hoặc 'pH hiệu quả'). H0 cho 100% HF ước tính từ -10,2 đến -11, tương đương với giá trị -12 cho axit sulfuric.
Xét về mặt nhiệt động lực học, các dung dịch HF rất không lý tưởng, với hoạt động của HF tăng nhanh hơn nhiều so với nồng độ của nó. Độ axit yếu trong dung dịch pha loãng đôi khi được cho là do sức bền liên kết H-F cao kết hợp với khả năng hòa tan cao của HF lớn hơn so với enthalpy tiêu cực của hydrat hóa ion fluoride. Tuy nhiên, Giguère và Turrell đã chỉ ra qua phổ hồng ngoại rằng các chất tan chủ yếu là cặp ion liên kết hydro [H3O + · F-], cho thấy rằng sự ion hóa này có thể được mô tả như một sự cân bằng liên tục:
- H2O + HF Mẫu:EqmR [H3O·F]
- [H3O·F] Mẫu:EqmL H3O + F
Hợp chất hydro |
|---|
Hợp chất fluor |
|---|
