1. Định nghĩa về nồng độ đương lượng
Nồng độ đương lượng của một chất là khối lượng của chất đó cần để thay thế hoặc phản ứng hoàn toàn với 1 đơn vị khối lượng hiđro (H) hoặc 8 đơn vị khối lượng oxi (O).
H2 + 1/2O2 → H2O
2g 16g
1g 8g
ĐH = 1; ĐO = 8
CuO + H2 → Cu + H2O
80g 2g
40g 1g => ĐCuO = 40
2Al + 3/2O2 → Al2O3
54g 48g
9g 8g => Al = 9
Fe + 2HCl → FeCl2 + H2↑
56g 2g
28g 1g => ĐFe = 28
(28g Fe thay thế 1g H trong HCl, do đó đương lượng của Fe là 28)
Na + CH3COOH → CH3COONa + 1/2H2↑
23g 1g => ĐNa = 23
- Đương lượng gam của một chất là khối lượng của chất đó tính bằng gam mà số đó chính là đương lượng của chất. Đây là khối lượng của chất có thể phản ứng hoặc thay thế vừa đủ với 1 gam H hoặc 8 gam O.
- Khái niệm về đương lượng gam tương tự như khái niệm nguyên tử lượng và phân tử lượng so với nguyên tử gam và phân tử gam. Do đó, một đương lượng gam của một chất có thể thay thế hoặc phản ứng hoàn toàn với 1 mol H (1 nguyên tử gam H) hoặc 0,5 mol O (0,5 nguyên tử gam O).
- Ví dụ:
ĐH = 1 => Đương lượng gam của H (ĐlgH) = 1 gam
ĐO = 8 => ĐlgO = 8 g (8 g O phản ứng hoàn toàn với 1 g H. Hay 1 đlg O phản ứng hoàn toàn với 1 đlg H. Hay 0,5 mol O phản ứng hoàn toàn với 1 mol H)
ĐAl = 9 => ĐlgAl = 9 g (9 g Al phản ứng hoàn toàn với 1 g H hoặc 8 g O. Hay 1 đlg Al phản ứng hoàn toàn với 1 đlg H hoặc 1 đlg O. Hay 1 đlg Al phản ứng hoàn toàn với 1 mol H hoặc 0,5 mol O)
ĐCuO = 40 => ĐlgCuO = 40 g (40 g CuO phản ứng hoàn toàn với 1 g H. Hay 1 đlg CuO phản ứng hoàn toàn với 1 đlg H).
2. Mối quan hệ giữa đương lượng và khối lượng nguyên tử
Mối liên hệ giữa đương lượng với khối lượng nguyên tử và khối lượng phân tử (tức là sự liên hệ giữa đương lượng gam với khối lượng mol nguyên tử và khối lượng mol phân tử)
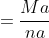
- Trong đó:
+ Đương lượng (hoặc đương lượng gam) của chất A được xác định bởi:
+ Khối lượng nguyên tử hoặc phân tử (khối lượng mol nguyên tử, khối lượng mol phân tử, nguyên tử gam, phân tử gam) của A: nA
+ Hóa trị của A (nếu A là kim loại): - Số ion H+ mà một phân tử axit đã tham gia phản ứng - Số ion OH- mà một phân tử bazơ đã tham gia phản ứng
- Số điện tử mà một phân tử chất oxi hóa nhận được
- Số điện tử mà một phân tử chất khử đã cho đi
- Số điện tích âm hoặc dương mà một phân tử muối, oxit kim loại, axit, bazơ đã tham gia trao đổi (phản ứng)
- Nói chung, một phân tử A chứa nA đương lượng của A hoặc 1 mol (1 nguyên tử gam, 1 phân tử gam) của A chứa nA đương lượng gam của A
Ví dụ:
ĐAl = 3 27 = Al Al n M = 9 (Đương lượng của nhôm là 9; Đương lượng gam của nhôm là 9 gam; 1 nguyên tử Al có 3 đương lượng Al; 1 mol Al có 3 đương lượng gam Al)
ĐFe(II) = 2 56 = Fe Fe n M = 28 (Đương lượng của sắt (II) là 28; Đương lượng gam của Fe(II) là 28 g)
ĐFe(III) = 3 56 = Fe n Fe = 18,67 (Đương lượng của sắt (III) là 18,67; Đương lượng gam của Fe(III) là 18,67 g)
H2SO4 + 2KOH → K2SO4 + 2H2O
1 mol 2 mol
2 đlg 2 đlg
Đ H2SO4 = 49 2 98 2 4 2 4 = H SO H SO n M (1 mol H2SO4 chứa 2 đương lượng H2SO4)
ĐKOH = 56 : 1 = 56 = KOH
KOH n M (1 mol KOH chứa 1 đương lượng KOH)
Do đó, 1 mol H2SO4 phản ứng hoàn toàn với 2 mol KOH;
3. Công thức để tính nồng độ đương lượng của một hợp chất
- Trong trường hợp phản ứng trao đổi ion
+ n = số điện tích của ion
+ E gam = M / số điện tích của ion
- Ví dụ
Phản ứng: 3 Ag+ + PO4^3- → Ag3PO4
Từ đó: E gam Ag+ = MAg+ / 1 = 108
Egam PO4^3- = MPO4^3- / 3 = 98 / 3
4. Định luật đương lượng
- Định luật đương lượng: Các chất khi phản ứng, thay thế, hoặc kết hợp với nhau sẽ có số đương lượng bằng nhau. Nếu VA lít dung dịch chất A có nồng độ đương lượng CA (mỗi lít dung dịch chứa CA đương lượng gam A) phản ứng vừa đủ với VB lít dung dịch chất B có nồng độ đương lượng CB (mỗi lít dung dịch chứa CB đương lượng gam B), thì số đương lượng gam của A và B trong hai thể tích này là bằng nhau:
CAVA = CBVB
- Trong công thức này, CA và CB thể hiện nồng độ đương lượng (N, độ nguyên chuẩn, biểu thị số đương lượng gam chất tan trong 1 lít dung dịch, đlg/L). VA và VB có thể là bất kỳ đơn vị thể tích nào, miễn là phải cùng đơn vị. Công thức này thường được sử dụng trong định phân để xác định nồng độ của dung dịch khi biết nồng độ dung dịch phản ứng và thể tích các dung dịch phản ứng vừa đủ (với 3 số hạng đã biết, có thể tính được số hạng còn lại).
- Nói một cách đơn giản, định luật đương lượng cho biết: trong phản ứng oxi hóa khử, số mol điện tử mà chất khử cung cấp bằng số mol điện tử mà chất oxi hóa nhận. Trong phản ứng trung hòa giữa axit và bazơ, số mol ion H+ của axit bằng số mol ion OH- của bazơ (để tạo thành nước không điện ly). Trong phản ứng trao đổi giữa các muối, bazơ, và axit, số mol điện tích dương của ion dương bằng số mol điện tích âm của ion âm (tạo ra phân tử trung hòa điện tích hoặc chất kết tủa, trầm tích, chất dễ bay hơi, chất không điện ly, hoặc chất điện ly yếu hơn).
5. Bài tập liên quan đến nồng độ đương lượng
Ví dụ 1: Để trung hòa hoàn toàn 10 mL dung dịch HCl, cần sử dụng 8 mL dung dịch NaOH 0,1N. Xác định nồng độ dung dịch HCl. (Trung hòa được xác định qua sự đổi màu của phenolptalein, trong môi trường axit phenolptalein không màu. Khi dư NaOH làm môi trường có tính kiềm pH > 8, phenolptalein chuyển màu tím sen nhạt. Giọt NaOH dư được xem là sai số của phép định phân thể tích).
Giải chi tiết:
Khi phản ứng trung hòa hoàn toàn: CHClVHCl = CNaOHVNaOH => CHCl = 0,08 N
(Dung dịch HCl có nồng độ 0,08 N hoặc 0,08 M, vì 1 mol HCl chứa 1 đương lượng gam HCl)
Ví dụ 2: Để phản ứng hoàn toàn 10 mL dung dịch I2, cần 12 mL dung dịch Na2S2O3 0,1N. Xác định nồng độ dung dịch I2. (Phản ứng được xác định qua sự mất màu vàng của dung dịch I2 hoặc mất màu xanh dương của hồ tinh bột trong dung dịch I2. Nếu còn dư I2, dung dịch vẫn còn màu xanh do hồ tinh bột, hết I2 thì dung dịch mất màu xanh dương).
Ví dụ 3: Khi cho từ từ dung dịch KMnO4 0,1 N vào 10 mL dung dịch FeSO4 trong môi trường axit H2SO4, thấy rằng khi thêm đến 9 mL dung dịch KMnO4 thì không còn mất màu tím nữa. Xác định nồng độ của dung dịch FeSO4 và số mol KMnO4 đã phản ứng trong 9 mL dung dịch.
Giải chi tiết:
Khi phản ứng đạt trạng thái hoàn toàn: CFeSO4 VFeSO4 = CKMnO4 VKMnO4
=> CFeSO4 = 0,09 N
(Dung dịch FeSO4 có nồng độ 0,09 N hoặc 0,09 M. Một phân tử FeSO4 nhường 1 electron để tạo Fe2(SO4)3, nên 1 mol FeSO4 có 1 đương lượng khử FeSO4). Một phân tử KMnO4 trong môi trường axit nhận 5 electron, bị khử thành MnSO4, do đó 1 mol KMnO4 có 5 đương lượng oxi hóa KMnO4. Trong 9 mL dung dịch KMnO4 0,1 N có: 9 × 10⁻³ L × (0,1 đlg/L) = 9 × 10⁻⁴ đlg KMnO4, hay 9 × 10⁻⁴ đlg × (1 mol/5 đlg) = 1,8 × 10⁻⁴ mol KMnO4.
Chú ý: - Công thức CtVt = CsVs hay CV = C’V’ cũng áp dụng để tính toán thể tích dung dịch có nồng độ cao cần pha loãng (với nước cất) để thu được dung dịch có nồng độ thấp hơn. Công thức này thể hiện rằng số mol hoặc số đương lượng gam chất tan trong dung dịch sau khi pha loãng bằng số mol hoặc số đương lượng gam chất tan trong dung dịch trước khi pha loãng. Vt và Vs là thể tích dung dịch trước và sau khi pha loãng (cùng đơn vị thể tích). Ct và Cs là nồng độ mol/L hoặc đlg/L của dung dịch trước và sau khi pha loãng. Đối với định phân, C bắt buộc phải là nồng độ đlg/L. Đối với pha loãng dung dịch, C có thể là nồng độ mol/L hoặc đlg/L.
Ví dụ: Để pha chế 100 mL dung dịch NaOH 0,1 M từ dung dịch NaOH 0,15 M, cần tính toán thể tích dung dịch NaOH 0,15 M cần dùng:
CtVt = CsVs => Vt = CsVs / Ct => Vt = 0,1 M × 100 mL / 0,15 M = 66,67 mL dung dịch NaOH 0,15 M. Lấy 66,67 mL dung dịch NaOH 0,15 M vào bình định mức 100 mL, thêm nước cất cho đủ 100 mL sẽ thu được dung dịch NaOH 0,1 M.
Cần bao nhiêu thể tích dung dịch KMnO4 1 N để pha thành 250 mL dung dịch KMnO4 0,05 N? CtVt = CsVs => Vt = CsVs / Ct => Vt = 0,05 N × 250 mL / 1 N = 12,5 mL dung dịch KMnO4 1 N.
- Đối với các axit đa nguyên tử (như H2SO4, H3PO4) và các bazơ đa nguyên tử (như Ca(OH)2), cùng với các chất oxi hóa và khử có khả năng nhận hoặc nhường điện tử khác nhau, số trị đương lượng của một phân tử có thể thay đổi tùy thuộc vào loại phản ứng.
- Trong thực tế pha chế, người ta thường dựa vào số lượng ion H+ trong phân tử axit hoặc số ion OH- trong phân tử bazơ để xác định số đương lượng gam của axit hay bazơ trong một mol. Đối với các chất oxi hóa và khử, người ta dựa vào phản ứng điển hình của chúng trong phản ứng oxi hóa khử để xác định số đương lượng gam trong một mol chất đó. Hoặc có thể dựa vào phản ứng xảy ra trong định phân để xác định số đương lượng gam trong một mol chất tan, từ đó pha chế dung dịch phù hợp, nồng độ đương lượng phụ thuộc vào phản ứng cụ thể.
