
Trong hóa học hữu cơ, alkyn (tiếng Anh: alkyne /ˈæl.kaɪn/) là hydrocarbon không no chứa liên kết ba giữa các nguyên tử carbon (CC). Một số alkyn điển hình như acetylen (CHCH), propyn (CHC-CH3), but-1-yn (CHC-CH2CH3)... hình thành dãy đồng đẳng alkyn với công thức tổng quát CnH2n-2 (n 2).
Tổng quan
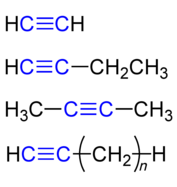
Dãy đồng đẳng và quy tắc đặt tên của alkyn bao gồm liên kết ba
Dãy đồng đẳng của alkyn bao gồm các hợp chất như acetylen, propyn, but-1-yn, but-2-yn... với công thức tổng quát đã nêu. Tên gọi thông thường của alkyn là tên cơ bản của hydrocarbon kết hợp với hậu tố 'acetylen.' Ví dụ: CHCH (acetylen), CH3CCH (methylacetylen), CH3CCCH2CH3 (ethylmethylacetylen), v.v..
Tên của alkyn cũng có thể được xác định theo quy tắc của IUPAC: tên của alkyn xuất phát từ tên alkan tương ứng, chỉ cần đổi hậu tố -an thành -yn và thêm số chỉ vị trí của liên kết ba khi cần thiết. Ví dụ: CHCH (ethyn), CHC-CH3 (propyn), CHCCH2CH3 (but-1-yn), CH3CCCH3 (but-2-yn)... Việc thêm số chỉ vị trí là cần thiết vì but-1-yn và but-2-yn là các đồng phân có tính chất khác nhau, như but-1-yn có thể phản ứng với AgNO3 trong môi trường NH3, trong khi but-2-yn thì không.
Đồng phân
Các hợp chất alkyn đầu dãy như C2H2 (acetylen) và C3H4 (propyn) không có đồng phân. Các alkyn từ C4H6 trở lên có đồng phân về vị trí liên kết ba, và từ C5H8 trở lên còn có cả đồng phân về mạch carbon (tương tự như alken).
Ví dụ về đồng phân vị trí liên kết bội: but-1-yn và but-2-yn là hai đồng phân khác nhau về vị trí của liên kết ba. Trong but-1-yn (CHC-CH2CH3), liên kết ba nằm giữa carbon đầu tiên và carbon thứ hai, trong khi đó ở but-2-yn (CH3-CC-CH3), liên kết ba nằm giữa carbon thứ hai và carbon thứ ba.
Ví dụ về đồng phân mạch carbon: pent-1-yn (CHC-CH2CH2CH3) và 3-methylbut-1-yn (CHC-CH(CH3)-CH3) đều có liên kết ba giữa các nguyên tử carbon 1 và 2 của mạch chính, nhưng mạch của pent-1-yn là thẳng còn 3-methylbut-1-yn có mạch nhánh với nhánh ở carbon số 3.
Khác với alken, alkyn không có đồng phân hình học (cis-trans). Đồng thời, alkyn cũng không có đồng phân nhóm chức, đồng phân vị trí nhóm chức, hay đồng phân quang học.
Cấu hình không gian và liên kết ba

Trong phân tử acetylen, góc liên kết giữa H-CC là 180 độ, khiến phân tử có dạng thẳng khi nhìn từ phía trước, khác biệt so với dạng gấp khúc của alkan. Do vậy, việc tìm thấy alkyn vòng là rất hiếm.
Chiều dài liên kết ba CC khoảng 121 picomet, ngắn hơn liên kết C=C trong alken (134 pm) và C-C trong alkan (153 pm). Liên kết ba có năng lượng 839 kJ/mol, với liên kết sigma (σ) là 369 kJ/mol, liên kết pi (π) thứ nhất 268 kJ/mol, và liên kết pi thứ hai 202 kJ/mol. Theo thuyết liên kết hóa trị, trong liên kết C1C2, một orbital lai hóa sp của carbon số 1 kết hợp với một orbital lai hóa của carbon số 2 tạo thành liên kết sigma, trong khi hai orbital 2p chưa lai hóa của C1 và C2 tạo hai liên kết pi. Vì vậy, liên kết ba CC của alkyn gồm một liên kết sigma và hai liên kết pi.
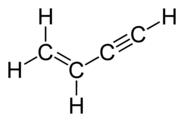
Alkyn có thể chứa nhiều liên kết bội
Alkyn có thể có nhiều liên kết ba trong phân tử. Để đặt tên cho hợp chất, hậu tố -yn được thay bằng -adiyn, -atriyn... Ví dụ: CHCCH2CH2CCH (hexa-1,5-điyn). Alkyn cũng có thể chứa cả liên kết đôi và liên kết ba. Trong trường hợp này, ta sử dụng cả hậu tố 'en' và 'yn', với liên kết đôi được ghi trước liên kết ba. Ví dụ: CHCCH2CH2CH=CH2 (hex-5-en-1-yn), CHC-CH=CH2 (but-3-en-1-yn, vinylacetylen)...
Đặc điểm của alkyn
Đặc điểm vật lý
Alkyn là loại hydrocarbon không phân cực, với các liên kết CC và CH đều là liên kết cộng hóa trị không phân cực. Do đó, chúng không hòa tan trong nước, tương tự như alken và alkan. Alkyn có khối lượng riêng thấp hơn nước. Nói chung, khi kích thước phân tử tăng, nhiệt độ nóng chảy, nhiệt độ sôi, và khối lượng riêng của alkyn cũng tăng. Các alkyn thường có nhiệt độ sôi cao hơn và khối lượng riêng lớn hơn so với các alken tương ứng (cùng số nguyên tử carbon).
| Danh pháp alkyn | Nhiệt độ nóng chảy (C) | Nhiệt độ sôi (C) | Khối lượng riêng (g/cm³) ở 20C |
|---|---|---|---|
| Ethyn | -82 | -75 | |
| Propyn | -101,5 | -23 | |
| But-1-yn | -122 | 8 | |
| pent-1-yn | -98 | 40 | 0,695 |
| hex-1-yn | -124 | 72 | 0,716 |
| hept-1-yn | -80 | 100 | 0,733 |
| oct-1-yn | -70 | 126 | 0,746 |
| non-1-yn | 151 | 0,757 | |
| dec-1-yn | 174 | 0,766 |
Đặc điểm hóa học
Phản ứng cộng
Phản ứng cộng với hydro (hydro hóa)
Khi có mặt chất xúc tác như nickel hoặc platin, alkyn phản ứng với hydro để tạo ra alken trước, sau đó là alkan tương ứng. Ví dụ: .
Tuy nhiên, khi sử dụng chất xúc tác là paladi, đặc biệt là với PbCO3 (chì carbonat) hoặc BaSO4 (bari sulfat), hoạt tính của niken và platin giảm đi và phản ứng chỉ dừng lại ở alken: .
Phản ứng hydro hóa chỉ làm đứt liên kết pi mà không ảnh hưởng đến liên kết sigma.
Phản ứng cộng với halogen (Br2, Cl2)
Alkyn cũng tham gia phản ứng cộng với halogen như brom và clo, tạo ra các dẫn xuất halogen của hydrocarbon. Tương tự như phản ứng hydro hóa, brom và clo cũng phản ứng với alkyn, làm đứt liên kết pi trong phân tử: . Nhìn chung, alkyn mất màu nước chậm hơn alken và quá trình phản ứng này khó hơn so với giai đoạn đầu.
Phản ứng cộng với HX và quy tắc Markovnikov
X có thể là nhóm hydroxyl (-OH), halide như bromide hoặc chloride, hoặc muối của acid carboxylic như acetat.
Quy tắc Markovnikov
Trước khi áp dụng quy tắc cộng, cần hiểu khái niệm bậc của nguyên tử carbon (C). Bậc của nguyên tử carbon trong phân tử hydrocarbon được xác định bởi số liên kết của nó với các nguyên tử carbon khác. Ví dụ, trong phân tử propyn: C(a)HC(b)-C(c)H3, nguyên tử carbon ở vị trí (a) và (c) có bậc carbon là 1 do chỉ liên kết với một carbon khác (ở vị trí (b)), trong khi bậc của nguyên tử C ở vị trí (b) là 2 do liên kết với hai carbon khác (ở vị trí (a) và (c)). Nói chung, carbon có bậc cao hơn có liên kết với nhiều nguyên tử carbon khác hơn.
Khi các carbon trong alkyn đều có bậc giống nhau (bậc 1), sản phẩm của phản ứng cộng HX thường chỉ tạo ra một sản phẩm duy nhất. Ví dụ, khi CHCH phản ứng với HCl, chỉ tạo ra vinyl chloride (CH2=CH-Cl). Tương tự, but-2-en (CH3-CC-CH3) cũng chỉ tạo ra một sản phẩm là CH3CCl=CHCH3.
Khi các carbon trong alkyn có bậc khác nhau, sản phẩm của phản ứng cộng sẽ có hai loại: sản phẩm chính và sản phẩm phụ. Quy tắc Markovnikov giúp xác định sản phẩm chính và phụ bằng cách chỉ ra rằng proton H sẽ cộng vào carbon bậc thấp (nhiều hydro hơn) trong khi nhóm X tích điện âm sẽ cộng vào carbon bậc cao (liên kết với nhiều carbon hơn). Ví dụ, trong propyn (C(1)HC(2)-CH3), carbon (1) có bậc 1 và carbon (2) có bậc 2, nên khi phản ứng với HBr, H sẽ cộng vào carbon C1 và Br vào carbon C2, tạo ra sản phẩm chính CH2=CBr-CH3. Tương tự, phản ứng giữa but-1-yn (CHC-CH2CH3) và HCl sẽ tạo ra sản phẩm chính là CH2=CClCH2CH3.
Ngoài HCl, khi thêm peroxide (có công thức R - O - O - R', với R và R' là hydrocarbon), phản ứng sẽ xảy ra theo nguyên tắc ngược lại với quy tắc Markovnikov, được gọi là quy tắc anti-Markovnikov. Ví dụ, trong phản ứng giữa propyn (CHC-CH3) và HBr, sản phẩm chính thường là CH2=CBr-CH3. Tuy nhiên, khi có peroxide, sản phẩm chính sẽ là CHBr-CH-CH3.
Phản ứng cộng với halide

Phản ứng cộng halide diễn ra qua hai giai đoạn, tương tự như phản ứng cộng với halogen, trong đó giai đoạn sau thường phức tạp hơn. Ví dụ: CH≡CH → HCl, xt → CH2=CH-Cl → HCl, xt → CH3-CHCl2. Trong phản ứng này, acetylen phản ứng với HCl, phá vỡ một liên kết pi để tạo vinyl chloride (CH2=CH-Cl). Nếu vinyl chloride tiếp tục phản ứng với HCl, sẽ tạo ra 1,1-dichloroethan (CH3CHCl2). Vinyl chloride là nguyên liệu chính để sản xuất poly(vinyl chloride), viết tắt là PVC. Để điều chế vinyl chloride, người ta sử dụng hỗn hợp acetylen và HCl với tỷ lệ 1:1 qua chất xúc tác HgCl2 ở nhiệt độ từ 150 - 200°C.
Với thuốc tím (KMnO4)
Trong môi trường không acid: 3C2H2 + 8KMnO4 → 3KOOC-COOK + 2KOH + 8MnO2 + 2H2O
Trong môi trường có acid H2SO4: 5C2H2 + 8KMnO4 + 12H2SO4 → 5(COOH)2 + 4K2SO4 + 8MnSO4 + 12H2O
2C2H2 → vinyl axetilen (điều kiện: CuCl, 150°C)
3C2H2 → C6H6 (điều kiện: than hoạt tính, 600°C)
Phản ứng cháy
CnH2n-2 + O2 → nCO2 + (n-1)H2O
Phản ứng thế với ion kim loại
CH≡CH + 2AgNO3 + 2NH3 → CAg≡CAg + 2NH4NO3
Quá trình điều chế
Ứng dụng trong công nghiệp
Từ methane (CH4)
- 2 CH4 → C2H2 + 3 H2
Trong phòng thí nghiệm
Từ đất đèn (CaC2)
- CaC2 + 2 H2O → C2H2 + Ca(OH)2
Liên kết ngoài
- Tài liệu về Alkynes trên Wikimedia Commons
- Alkyne trên Encyclopædia Britannica (tiếng Anh)
- ANKIN trên Từ điển bách khoa Việt Nam
| Tiêu đề chuẩn |
|
|---|
Phân nhánh hóa học |
|---|
Các nhóm chức |
|---|
Hydrocarbon |
|---|
