

| Bari hydroxide | |
|---|---|
| Nhận dạng | |
| Số CAS | 17194-00-2 |
| PubChem | 28387 |
| ChEBI | 32592 |
| Số RTECS | CQ9200000 |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ |
| InChI | đầy đủ |
| Tham chiếu Gmelin | 846955 |
| Thuộc tính | |
| Công thức phân tử | Ba(OH)2 |
| Khối lượng mol | 171.34 g/mol (khan) 189.355 g/mol (ngậm 1 nước) 315.46 g/mol (ngậm 8 nước) |
| Bề ngoài | chất rắn màu trắng |
| Khối lượng riêng | 3.743 g/cm³ (ngậm 1 nước) 2.18 g/cm³ (ngậm 8 nước, 16 °C) |
| Điểm nóng chảy | 78 °C (351 K; 172 °F) (ngậm 8 nước) 300 °C (ngậm 1 nước) 407 °C (khan) |
| Điểm sôi | 780 °C (1.050 K; 1.440 °F) |
| Độ hòa tan trong nước | chủ yếu BaO (không có Ba(OH)2): 1.67 g/100 mL (0 °C) 3.89 g/100 mL (20 °C) 4.68 g/100 mL (25 °C) 5.59 g/100 mL (30 °C) 8.22 g/100 mL (40 °C) 11.7 g/100 mL (50 °C) 20.94 g/100 mL (60 °C) 101.4 g/100 mL (100 °C) |
| Độ hòa tan trong các dung môi khác | low |
| Độ bazơ (pKb) | 0.15 (first OH), 0.64 (second OH) |
| MagSus | -53.2·10 cm³/mol |
| Chiết suất (nD) | 1.50 (ngậm 8 nước) |
| Cấu trúc | |
| Cấu trúc tinh thể | octahedral |
| Nhiệt hóa học | |
| Enthalpy hình thành ΔfH298 | −944.7 kJ/mol |
| Các nguy hiểm | |
| Phân loại của EU | Harmful (Xn) |
| NFPA 704 |
0
3
0
|
| Chỉ dẫn R | R20/22 |
| Chỉ dẫn S | S2, S28 |
| Điểm bắt lửa | Không bắt lửa |
| Các hợp chất liên quan | |
| Anion khác | Bari oxit Bari peroxide |
| Cation khác | Calci hydroxide Magiê hydroxide Stronti hydroxide |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa).
(cái gì ?)
Tham khảo hộp thông tin | |
Hydroxide bari là hợp chất hóa học có công thức Ba(OH)2(H2O)x. Chất đơn ngậm nước (x =1) còn được gọi là baryta, và là một trong những hợp chất chủ yếu của bari. Dạng monohydrat màu trắng này thường được sử dụng trong công nghiệp.
Phương pháp tổng hợp và cấu tạo
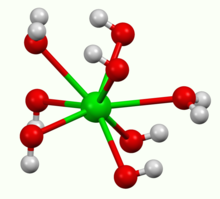
Hydroxide bari có thể được sản xuất bằng cách hòa tan bari oxit (BaO) trong nước.
- BaO + 9 H2O → Ba(OH)2·8H2O
Hợp chất này kết tinh thành dạng ngậm 8 phân tử nước octahydrate, và chuyển thành dạng ngậm đơn nước monohydrate khi được nung nóng trong không khí. Ở nhiệt độ 100 °C trong chân không, monohydrat sẽ phân giải thành BaO và nước. Dạng monohydrat có cấu trúc lớp (như hình trên). Trung tâm Ba có cấu trúc vuông góc hình trụ. Mỗi ion Ba được liên kết với hai phân tử nước và sáu phân tử hydroxide, với liên kết đôi và liên kết ba với các ion lân cận. Trong dạng ngậm 8 phân tử nước, các ion Ba kết nối mà không chia sẻ các phối tử.
Ứng dụng
Trong công nghiệp, bari hydroxide được sử dụng làm nguyên liệu để sản xuất các hợp chất bari khác. Dạng monohydrat của bari hydroxide được dùng để loại bỏ nước và sulfat từ các sản phẩm khác nhau, nhờ vào tính tan rất thấp của bari sulfat. Ứng dụng này cũng được áp dụng trong phòng thí nghiệm.
Hợp chất bari |
|---|
- Cổng thông tin Hóa học
