1. Khái niệm ion đa nguyên tử là gì?
1.1. Ion là gì?
Ion, hay còn gọi là điện tích, là một nguyên tử hoặc nhóm nguyên tử bị mất hoặc nhận thêm một hoặc nhiều electron. Khi ion thu thêm electron và mang điện tích âm, nó được gọi là anion. Ngược lại, khi ion mất electron và mang điện tích dương, nó được gọi là cation. Quá trình này được gọi là ion hóa.
Kim loại thường tạo ra các cation (bằng cách mất electron), trong khi phi kim lại tạo ra anion.
1.2. Ion đa nguyên tử
Ion đa nguyên tử, hay còn gọi là ion phân tử, là nhóm hai nguyên tử hoặc nhiều hơn liên kết bằng liên kết cộng hóa trị, có thể xem như một đơn vị và mang điện tích không bằng 0, tức là không trung hòa về điện.
Trước đây, ion đa nguyên tử thường được gọi là gốc tự do. Hiện nay, thuật ngữ 'gốc' được sử dụng để chỉ các gốc tự do khác, tức những nguyên tử, phân tử hoặc ion có electron đơn lẻ mà không nhất thiết phải mang điện tích.
2. Cách gọi tên các ion đa nguyên tử
Có hai quy tắc cơ bản để nhớ cách gọi tên các anion đa nguyên tử.
Khi thêm tiền tố bi- vào tên, một nguyên tử hydro được bổ sung vào công thức ion và điện tích của nó sẽ tăng thêm 1 đơn vị. Một phương pháp khác là dùng từ hydro trong tên gọi: ví dụ anion HCO3 được tạo từ H+ và CO3 (2-)
Hầu hết các ion đa nguyên tử thường thấy đều là anion oxi, các base liên hợp của axit oxi (các axit được hình thành từ oxit của phi kim)
Ví dụ: anion sunfat SO4 (2-) từ H2SO4 có thể được xem là SO3 cộng với H2O
Quy tắc thứ hai là xem xét số lượng nguyên tử oxi trong ion. Hãy xem xét nhóm anion oxi của clo:
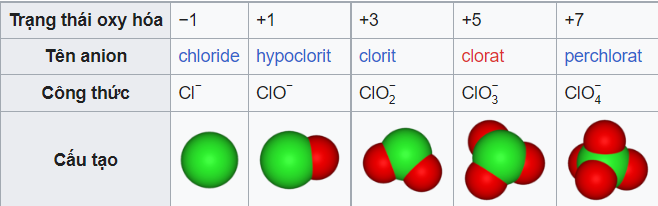
Khi đuôi -ate được coi là tên của base, việc thêm tiền tố pe- sẽ bổ sung một nguyên tử oxi. Đổi hậu tố -ate thành -ite giảm số oxi xuống một đơn vị, và thêm tiền tố hypo- để giảm thêm một oxi nữa. Trong tất cả các trường hợp, điện tích của ion không thay đổi. Phương pháp đặt tên này áp dụng cho nhiều nhóm anion oxi dựa trên một ion gốc của nhóm đó. Hậu tố -ite có ít oxi hơn hậu tố -ate, nhưng các anion -ate khác có thể có số nguyên tử oxi khác nhau.
Mặc dù hai quy tắc trên không áp dụng cho tất cả các ion đa nguyên tử, chúng vẫn đúng cho hầu hết các anion thường gặp.
Bảng dưới đây cung cấp ví dụ về một số nhóm anion phổ biến
| bromide | hypobromit | bromit | bromat | pebromat |
| Br - | BrO - | BrO2 - | BrO3 - | BrO4 - |
| iodide | hypoiotit | iotit | iotat | prioat |
| I - | IO - | IO2 - | IO3 - | IO4 - |
| sulfide | hyposunfit | sunfit | sunfat | pesunfat |
| S ( 2- ) | S2O2 ( 2- ) | SO3 ( 2-) | SO4 ( 2- ) | SO5 ( 2- ) |
| selenide | hyposelenide | selenide | selenat | |
| Se ( 2- ) | Se2O2 ( 2- ) | SeO3 ( 2- ) | SeO4 ( 2- ) | |
| telurua | hypotelurit | telurit | telurat | |
| Te ( 2- ) | TeO2 ( 2- ) | TeO3 ( 2- ) | TeO4 ( 2- ) | |
| nitride | hyponitrit | nitrit | nitrat | |
| N ( 3- ) | N2O2 ( 2- ) | NO2 ( - ) | NO3 ( - ) | |
| phosphua | hypophosphit | phosphit | phosphat | pephosphat |
| P ( 3- ) | H2PO2 ( - ) | PO3 ( 3- ) | PO4 ( 3- ) | PO5 ( 3- ) |
| arenua | hypoasenit | arsenit | arsenat | |
| As ( 3- ) | AsO2 ( 3- ) | AsO3 ( 3- ) | AsO4 ( 3- ) |
Chất nào trong số dưới đây chứa ion đa nguyên tử?
- Cơ chế hình thành ion: Nguyên tử vốn trung hòa về điện, nhưng khi nguyên tử mất hoặc nhận thêm electron, nó trở thành phân tử mang điện gọi là ion.
- Một ion đa nguyên tử, còn được gọi là nhóm hai nguyên tử hoặc phức chất, là tập hợp các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị. Nó có thể được coi như một đơn vị độc lập và mang điện tích khác không, tức không trung hòa về điện.
- Ion đa nguyên tử thường xuất hiện trong các phản ứng axit - base và trong sự hình thành muối. Thông thường, một ion đa nguyên tử có thể được xem như là một axit hay base liên hợp của một phân tử.
Ví dụ, base liên hợp của axit sulfuric là ion đa nguyên tử hydro sunfat. Khi loại bỏ một ion hydro, ta thu được anion sunfat.
- Trong các phản ứng hóa học, để đạt được cấu hình bền của khí hiếm, nguyên tử kim loại có xu hướng nhường electron lớp ngoài cùng cho nguyên tử khác, tạo thành phân tử mang điện dương, còn gọi là ion dương hoặc cation.
- Trong các phản ứng hóa học, để đạt được cấu hình bền của khí hiếm, nguyên tử phi kim có xu hướng nhận thêm electron từ nguyên tử khác, trở thành phần tử mang điện âm, gọi là ion âm hoặc anion.
- Các đặc điểm chung của hợp chất ion:
- Tinh thể ion rất ổn định nhờ lực hút tĩnh điện mạnh giữa các ion mang điện tích trái dấu trong tinh thể.
- Các hợp chất ion thường có tính rắn chắc, khó nóng chảy và bay hơi.
- Các hợp chất ion thường tan tốt trong nước.
4. Sự phân biệt giữa nguyên tố đa hóa trị và ion đa nguyên tử
Sự khác biệt chính giữa nguyên tố đa hóa trị và ion đa nguyên tử là các nguyên tố đa hóa trị có nhiều hóa trị khác nhau, trong khi ion đa nguyên tử gồm nhiều nguyên tử liên kết cộng hóa trị với nhau. Đa hóa trị chỉ ra rằng nguyên tố có thể dùng nhiều hơn một electron để tạo liên kết hóa học, trong khi đa nguyên tử chỉ ra rằng nhiều nguyên tử tham gia để hình thành ion.
5. Bài tập thực hành
Câu 1: Liên kết ion hình thành giữa
A. hai nguyên tử kim loại
B. hai nguyên tử phi kim
C. một nguyên tử kim loại mạnh và một nguyên tử phi kim mạnh
D. một nguyên tử kim loại yếu và một nguyên tử phi kim yếu
Câu 2: Trong cấu trúc tinh thể của NaCl, số lượng electron của các ion Na và Cl lần lượt là
A. 10 và 8
B. 12 và 16
C. 10 và 10
D. 11 và 17
Câu 3: Liên kết trong phân tử của chất nào sau đây có đặc điểm gần nhất với liên kết ion?
A. LiCl
B. NaCl
C. KCl
D. CsCl
Câu 4: Trong những dãy chất dưới đây, dãy nào chứa các chất có liên kết ion?
A. KBr, CS2, MgS
B. KBr, MgO, K2O
C. H2O, K2O, CO2
D. CH4, HBr, CO2









A. kim loại
B. liên kết cộng hóa trị
C. liên kết ion
D. liên kết cho - nhận
Câu 6: X và Y là hai nguyên tố với điện tích hạt nhân lần lượt là 9 và 19. Cấu hình electron lớp ngoài cùng của nguyên tử X, Y và loại liên kết trong hợp chất giữa X và Y là:













Câu 7: Đặc điểm chung của hầu hết các hợp chất ion là gì?
A. có nhiệt độ nóng chảy và sôi cao
B. dễ tan trong các dung môi hữu cơ
C. không dẫn điện khi ở trạng thái nóng chảy
D. hòa tan trong nước tạo dung dịch không dẫn điện
Câu 8: Bản chất của liên kết ion và lực hút tĩnh điện giữa
A. hai ion
B. hai ion có điện tích trái dấu
C. các hạt có điện tích trái dấu
D. hạt nhân và electron hóa trị
Câu 9: Nội dung nào dưới đây là sai khi nói về ion?
A. ion là phần tử có điện tích
B. ion âm gọi là cation, ion dương gọi là anion
C. ion có thể được phân loại thành ion đơn nguyên tử và ion đa nguyên tử
D. ion hình thành khi nguyên tử nhận hoặc nhường electron
Câu 10: Liên kết hóa học giữa các ion được gọi là:
A. liên kết anion - cation
B. liên kết ion
C. liên kết điện tích
D. liên kết ion
Trên đây là thông tin về ion đa nguyên tử và các chất chứa ion đa nguyên tử mà Mytour đã tổng hợp. Hy vọng bài viết sẽ hữu ích cho bạn đọc. Cảm ơn bạn đã theo dõi!
