1. Ion kim loại nào có khả năng oxi hóa mạnh nhất?
Câu hỏi: Ion kim loại nào có khả năng oxi hóa mạnh nhất?
A. Na+.
B. Cu2+.
C. Ag+.
D. Al3+.
Đáp án chính xác: Ion kim loại có tính oxi hóa mạnh nhất là Fe3+.

2. Phương pháp xác định khả năng oxi hóa của kim loại
- Tham khảo dãy điện hóa:
+ Dãy điện hóa kim loại: Là dãy xếp các kim loại theo mức độ giảm dần khả năng khử (tức là tăng dần khả năng oxi hóa của ion kim loại).
+ Nguyên tắc: Kim loại đứng trước trong dãy điện hóa có khả năng khử mạnh hơn, do đó ion của nó có khả năng oxi hóa yếu hơn so với kim loại đứng sau.
+ Ví dụ: Trong dãy điện hóa, K đứng trước Cu. Điều này có nghĩa là:
K có khả năng khử mạnh hơn Cu.
Ion K+ có khả năng oxi hóa kém hơn so với ion Cu2+.
- Tham khảo phản ứng hóa học:
+ Trong phản ứng với các kim loại khác: Kim loại có khả năng oxi hóa mạnh hơn sẽ thay thế kim loại có khả năng oxi hóa yếu hơn khỏi dung dịch muối.
Ví dụ: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag. Phản ứng này cho thấy Cu có khả năng khử mạnh hơn Ag, hay ion Ag+ có khả năng oxi hóa mạnh hơn ion Cu2+.
+ Phản ứng với axit: Kim loại đứng trước hydro trong dãy điện hóa sẽ phản ứng với dung dịch axit (HCl, H2SO4 loãng) và sinh ra khí H2.
+ Ví dụ: Zn + 2HCl → ZnCl2 + H2. Phản ứng này chứng minh rằng Zn có khả năng khử mạnh hơn H, tức là ion H+ có khả năng oxy hóa mạnh hơn ion Zn2+.
- Dựa vào cấu hình electron:
+ Kim loại với ít electron ở lớp vỏ ngoài thường có tính khử mạnh hơn, trong khi ion của nó có tính oxy hóa yếu hơn.
+ Lưu ý: Phương pháp này chỉ áp dụng cho các nguyên tử có cấu hình electron đơn giản.
- Ý nghĩa của việc xác định khả năng oxy hóa của kim loại:
+ Tiên đoán phản ứng có thể xảy ra: Dựa trên khả năng oxy hóa tương đối của các ion kim loại, chúng ta có thể dự đoán các phản ứng tiềm năng.
+ Lựa chọn chất khử và chất oxy hóa phù hợp: Trong các phản ứng oxy hóa-khử, việc chọn chất khử và chất oxy hóa chính xác dựa trên tính chất oxy hóa và khử của chúng.
+ Ứng dụng trong ngành công nghiệp: Ví dụ, trong quá trình điện phân, việc chọn điện cực dựa vào khả năng oxy hóa và khử của chúng.
3. Một số bài tập về khả năng oxy hóa của kim loại kèm đáp án
Câu 1: Cho m gam Na phản ứng hoàn toàn với 500 ml dung dịch Ba(OH)2 0,04M, thu được 500 ml dung dịch có pH = 13. Tính giá trị của m.
Chi tiết lời giải
Gọi số mol của Na là x mol
→ nNaOH = x mol
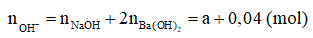
Dung dịch thu được có pH = 13
→ pOH = 14 – 13 = 1, do đó [OH-] = 10^-1 = 0,1M
→ x + 0,04 = 0,1 × 0,5
→ x = 0,01
→ Khối lượng Na là 0,23 gam
Giải chi tiết
Số mol H2 = 0,05 mol
Phương trình phản ứng hóa học: Fe + 2HCl → FeCl2 + H2
Theo phương trình phản ứng: số mol Fe = số mol H2 = 0,05 mol
→ m = mFe = 0,05 × 56 = 2,8 g
Câu 3: Hòa tan hoàn toàn sắt vào dung dịch H2SO4 loãng vừa đủ, thu được 4,48 lít khí H2 (ở điều kiện tiêu chuẩn). Sau khi cô cạn dung dịch trong môi trường không có oxy, thu được m gam muối khan. Tính giá trị của m.
Giải chi tiết
Số mol H2 = 0,2 mol
Phương trình phản ứng hóa học: Fe + H2SO4 → FeSO4 + H2
Dựa vào phương trình hóa học: số mol FeSO4 và H2 đều là 0,2 mol
→ Khối lượng FeSO4 tính được là: 0,2 × 152 = 30,4 g
Câu 4: Hòa tan 4,017 gam kim loại kiềm X vào nước dư tạo ra dung dịch Y. Để trung hòa dung dịch Y cần 0,103 mol HCl. X là kim loại nào?
A. Na.
B. Li.
C. Rb.
D. K.
Câu 5: Hòa tan hoàn toàn 6,2 gam hỗn hợp X gồm hai kim loại liên tiếp trong nhóm IA, thu được 2,24 lít khí hiđro (ở đktc). Hai kim loại A và B là
A. Li, Na.
B. Na, K.
C. K, Rb.
D. Rb, Cs.
Câu 6: Một hỗn hợp X chứa 3,6 gam K và một kim loại kiềm M phản ứng hoàn toàn với nước tạo ra 2,24 lít khí H2 (ở 0,5 atm và 0°C). Số mol của kim loại M chiếm hơn 10% tổng số mol của hai kim loại. Kim loại M là
A. K.
B. Na.
C. Li.
D. Rb.
Câu 7: Hòa tan hoàn toàn 8,5 gam hỗn hợp X gồm Na và K vào nước, thu được dung dịch Y và V lít khí H2 (ở đktc). Để trung hòa Y bằng H2SO4 và sau khi cô cạn dung dịch, thu được 22,9 gam muối. Tính giá trị của V
A. 6,72
B. 4,48
C. 3,36
D. 2,24
