| Kẽm sulfide | |
|---|---|
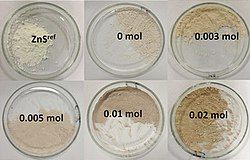
Mẫu kẽm sulfide khi pha trộn với lưu huỳnh ở các tỉ lệ khác nhau | |
| Tên khác | Zincblende Wurtzit |
| Nhận dạng | |
| Số CAS | 1314-98-3 |
| PubChem | 14821 |
| Số RTECS | ZH5400000 |
| Ảnh Jmol-3D | ảnh ảnh 2 |
| SMILES | đầy đủ |
| InChI | đầy đủ |
| ChemSpider | 14137 |
| UNII | KPS085631O |
| Thuộc tính | |
| Công thức phân tử | ZnS |
| Khối lượng mol | 97,456 g/mol |
| Bề ngoài | bột trắng khi tinh khiết chuyển sang màu vàng khi có lưu huỳnh |
| Khối lượng riêng | 4,09 g/cm³ |
| Điểm nóng chảy | 1.185 °C (1.458 K; 2.165 °F) (thăng hoa) |
| Điểm sôi | |
| Độ hòa tan trong nước | tan rất ít |
| BandGap | 3,54 eV (lập phương, 300 K) 3,91 eV (lục phương, 300 K) |
| Cấu trúc | |
| Cấu trúc tinh thể | Xem trong bài |
| Tọa độ | Tứ diện (Zn) Tứ diện (S) |
| Nhiệt hóa học | |
| Enthalpy hình thành ΔfH298 | -204,6 kJ/mol |
| Các nguy hiểm | |
| Nguy hiểm chính | độc |
| NFPA 704 |
0
1
0
|
| Điểm bắt lửa | không bắt lửa |
| Các hợp chất liên quan | |
| Anion khác | Kẽm oxit Kẽm selenide Kẽm teluride |
| Cation khác | Cadmi(II) sulfide Thủy ngân(I) sulfide Thủy ngân(II) sulfide |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa).
(cái gì ?)
Tham khảo hộp thông tin | |
Kẽm sunfua là một hợp chất vô cơ có công thức hóa học là ZnS. Đây là dạng tồn tại chính của kẽm trong tự nhiên, với khoáng vật phổ biến nhất là sphalerit. Ở dạng tinh khiết, khoáng vật này có màu trắng, nhưng thường xuất hiện màu đen do chứa nhiều tạp chất, và được sử dụng rộng rãi như một chất tạo màu. Khi được tổng hợp và nén chặt, kẽm sunfua có thể trong suốt, được dùng làm cửa sổ cho kính ánh sáng khả kiến và kính hồng ngoại.
Kết cấu
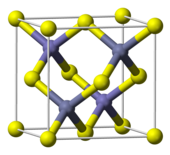
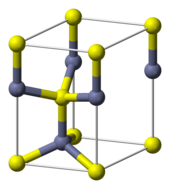
ZnS tồn tại dưới hai dạng kết tinh chính, mỗi dạng mang đặc tính riêng. Cả hai dạng đa hình đều có cấu trúc tứ diện giữa Zn và S. Dạng lập phương ổn định hơn được gọi là sphalerit, trong khi dạng lục phương được biết đến là wurtzit, nhưng cũng có thể được tổng hợp nhân tạo. Sự chuyển đổi từ sphalerit sang wurtzit diễn ra ở khoảng 1020 ℃. Dạng tứ diện hiếm gặp hơn có tên polhemusit, với công thức (Zn,Hg)S.
Nguồn gốc
ZnS phát sáng lân quang lần đầu được phát hiện vào năm 1866 bởi nhà hóa học người Pháp Théodore Sidot. A. E. Becquerel, nổi tiếng với nghiên cứu về phát quang, đã trình bày các khám phá của Sidot. ZnS sau đó được Ernest Rutherford và nhiều nhà khoa học khác sử dụng trong giai đoạn đầu của vật lý hạt nhân để chế tạo máy dò nhấp nháy, vì nó phát sáng khi bị kích thích bởi tia X hoặc chùm electron, khiến nó trở thành vật liệu quan trọng trong màn hình tia X và ống tia âm cực.
Công dụng
Vật liệu phát sáng
Kẽm sunfua, khi được pha thêm vài ppm chất kích hoạt phù hợp, có thể sử dụng trong nhiều ứng dụng từ ống phóng tia âm cực, màn hình tia X, cho đến các sản phẩm phát sáng trong bóng tối. Sử dụng bạc làm chất kích hoạt sẽ tạo ra ánh sáng xanh lam với bước sóng tối đa 450 nanomet. Khi dùng mangan, màu sắc sẽ chuyển sang vàng cam với bước sóng khoảng 590 nanomet. Đồng giúp kéo dài thời gian phát sáng, với màu xanh lục mờ trong bóng tối. Hợp kim kẽm sunfua pha đồng ('ZnS với Cu') cũng được dùng trong các tấm phát quang điện tử. Kẽm sunfua còn thể hiện tính lân quang khi có các tạp chất phát sáng xanh hoặc tử ngoại.
Vật liệu quang học
Kẽm sunfua cũng được dùng làm vật liệu quang học trong hồng ngoại, truyền sáng từ ánh sáng khả kiến đến bước sóng trên 12 µm. Nó có thể được chế tạo dưới dạng phẳng như cửa sổ quang học hoặc dạng cầu như thấu kính. Kẽm sunfua được sản xuất qua quá trình kết tinh từ phản ứng giữa khí hydro sunfua và hơi kẽm, và bán dưới dạng vật liệu FLIR (Forward Looking IR), trong đó kẽm sunfua có màu vàng sữa và đục. Khi được ép đẳng tĩnh ở nhiệt độ cao, nó trở nên trong suốt như nước, được gọi là Cleartran (thương hiệu). Trước đây, trên thị trường còn có dạng thương mại khác là Irtran-2, nhưng nay đã lỗi thời.
Chất tạo màu
Kẽm sunfua là một chất tạo màu phổ biến, đôi khi còn được gọi là sachtolith. Khi kết hợp với bari sunfat, nó tạo thành hợp chất lithopon, một chất tạo màu kẽm sunfua.
Chất xúc tác
Bột ZnS mịn là một chất xúc tác quang hiệu quả trong việc tạo khí hydro từ nước, phụ thuộc vào khả năng phát quang của nó. Lưu huỳnh có thể được tách ra từ ZnS trong quá trình tổng hợp, biến ZnS từ màu vàng trắng thành bột nâu và làm tăng hiệu suất xúc tác quang thông qua việc tăng cường hấp thụ ánh sáng.
Tính chất bán dẫn
Cả sphalerit và wurtzit đều là chất bán dẫn nội thuộc nhóm bán dẫn II-VI, với vùng cấm rộng. Chúng phù hợp với nhiều cấu trúc bán dẫn khác như gali(III) asenua. Dạng lập phương của ZnS có năng lượng vùng cấm khoảng 3,54 eV ở 300 K, trong khi dạng lục phương có vùng cấm khoảng 3,91 eV. ZnS có thể trở thành bán dẫn loại n hoặc bán dẫn loại p.
Sản xuất

Kẽm sulfide thường được sản xuất từ các vật liệu phế thải trong các ứng dụng khác. Nguồn phổ biến là từ các lò luyện kim, xỉ hoặc dung dịch rửa chua (pickle liquors). Nó cũng là sản phẩm phụ trong quá trình tổng hợp amonia từ metan, vì kẽm oxit được dùng để loại bỏ hydro sulfide trong khí tự nhiên.
- ZnO + H2S → ZnS + H2O
Điều chế trong phòng thí nghiệm
Kẽm sulfide có thể được tạo ra dễ dàng khi đốt cháy hỗn hợp kẽm và lưu huỳnh. Do không tan trong nước, ZnS cũng có thể được tạo ra bằng phản ứng kết tủa từ dung dịch muối kẽm khi có ion sulfide (như từ H2S).
- Zn + S → ZnS
Phản ứng này là cơ sở quan trọng trong phân tích khối lượng của kẽm.
Liên kết ngoài
- Kẽm và Lưu huỳnh trên Bảng Tuần Hoàn Video (Đại học Nottingham)
- Thành phần phosphor của CRT
- Đại học Reading, dữ liệu quang học từ Phòng thí nghiệm Lớp phủ hồng ngoại nhiều lớp
Hợp chất kẽm |
|---|
- Cổng thông tin về Hóa học
