



| Carbon monoxide | |
|---|---|
Cấu trúc phân tử của carbon monoxide | |
| Tổng quan | |
| Danh pháp IUPAC | carbon monoxide |
| Tên khác | carbon oxide oxide carbon khí than |
| Phân tử gam | 28,01 g/mol |
| Biểu hiện | Chất khí không màu, không mùi |
| Số CAS | [630-08-0] |
| Thuộc tính | |
| Tỷ trọng và pha | 1,145 kg/m³ ở 298 K 1,25 kg/m³ ở 273 K 8 kg/cm (rắn) |
| Độ hòa tan trong nước | 26 g/m³ ở 273 K |
| Nhiệt độ nóng chảy | -205°C (68 K) |
| Điểm sôi | -192°C (81 K) |
| Độ nhớt | ? cP |
| Khác | |
| MSDS | MSDS ngoài |
| Các nguy hiểm chính | Cực dễ cháy (F+) Độc (T) sinh sản: độc loại 1 |
| NFPA 704 | |
| Rủi ro/An toàn | R: 12, 23, 48/23, 61 S: 45, 53 |
| Số RTECS | FG3500000 |
| Dữ liệu hóa chất bổ sung | |
| Cấu trúc & thuộc tính | n εr, v.v. |
| Dữ liệu nhiệt động lực | Các trạng thái rắn, lỏng, khí |
| Dữ liệu quang phổ | UV, IR, NMR, MS |
| Các hợp chất liên quan | |
| Các hợp chất liên quan | carbon Metan, carbon dioxide |
| Ngoại trừ có thông báo khác, các dữ liệu được lấy ở 25 °C, 100 kPa Thông tin về sự phủ nhận và tham chiếu | |
Khí carbon monoxit, với công thức hóa học CO, là một loại khí không màu, không mùi, dễ cháy và cực kỳ độc hại. Nó là sản phẩm chính của quá trình cháy không hoàn toàn của carbon và các hợp chất chứa carbon.
Carbon monoxide có thể phát sinh từ nhiều nguồn khác nhau. Khí thải của động cơ đốt trong thường chứa carbon monoxide sau khi đốt các nhiên liệu gốc carbon, đặc biệt khi nhiệt độ không đủ cao để oxy hóa hoàn toàn các hydrocarbon thành nước và carbon dioxide, do thời gian đốt cháy quá ngắn hoặc thiếu oxy cần thiết. Thiết kế và vận hành buồng đốt để giảm CO khó hơn so với giảm lượng hydrocarbon chưa cháy. Carbon monoxide cũng xuất hiện trong khói thuốc lá và có thể tồn tại trong nhà khi các nhiên liệu như xăng, dầu hoặc gỗ không cháy hết trong các thiết bị như xe máy, ô tô, lò sưởi hoặc bếp. Khí CO có thể thấm qua bê tông trong nhiều giờ sau khi xe đã rời khỏi gara.
Trước đây, một số quốc gia sử dụng khí thành phố để thắp sáng và cung cấp nhiệt vào thế kỷ XIX. Khí thành phố được sản xuất bằng cách cho hơi nước đi qua than cốc nóng đỏ; hỗn hợp của hydro và carbon monoxide là sản phẩm của phản ứng giữa nước và carbon.
Ngày nay, khí này đã được thay thế bằng khí tự nhiên (methan) để giảm nguy cơ độc hại. Khí gỗ, sản phẩm của sự cháy không hoàn toàn của gỗ, cũng chứa carbon monoxide như một thành phần chính.
Nguy cơ độc hại
- Xem thêm chi tiết tại bài viết: Ngộ độc carbon monoxide
Carbon monoxide rất nguy hiểm; hít phải lượng lớn CO có thể dẫn đến tổn thương do thiếu oxy trong máu, ảnh hưởng đến hệ thần kinh, và thậm chí gây tử vong. Nồng độ chỉ khoảng 0,01% carbon monoxide trong không khí cũng đủ gây nguy hiểm đến tính mạng.
CO là một khí không màu, không mùi và không gây kích ứng, vì vậy rất khó phát hiện sự hiện diện của nó. CO liên kết với hemoglobin (Hb) trong hồng cầu mạnh gấp 250-280 lần so với oxy, dẫn đến việc máu không thể vận chuyển oxy đến các tế bào. CO cũng có thể gây tổn thương tim do gắn kết với myoglobin.
Các triệu chứng ngộ độc carbon monoxide thường bắt đầu bằng cảm giác chóng mặt, đau đầu, buồn nôn, và khó thở, sau đó có thể tiến triển thành hôn mê. Nếu ngộ độc xảy ra trong khi đang ngủ say hoặc say rượu, người bị ngộ độc có thể rơi vào trạng thái hôn mê từ từ, ngừng thở và có nguy cơ tử vong.
Ngộ độc CO có thể xảy ra trong những tình huống như máy phát điện chạy trong không gian kín, phụ nữ mang thai sử dụng lò than trong phòng kín, hoặc ngủ trong xe hơi đang nổ máy trong gara...
Quá trình phát hiện
Carbon monoxide lần đầu tiên được nhà hóa học Pháp de Lassone điều chế vào năm 1776 bằng cách đốt nóng oxide kẽm (ZnO) với than cốc. Tuy nhiên, ông nhầm lẫn khí thu được là hydro vì nó cũng cháy với ngọn lửa màu xanh lam. Đến năm 1800, nhà hóa học người Anh William Cruikshank đã xác định đây là một hợp chất chứa carbon và oxy.
Claude Bernard, nhà sinh lý học người Pháp, đã nghiên cứu sâu về độc tính của carbon monoxide vào khoảng năm 1846. Ông cho chó hít khí này và phát hiện máu của chúng tại các mạch máu có màu đỏ hơn.
Hóa học
Cấu trúc phân tử CO được mô tả chính xác qua thuyết quỹ đạo phân tử. Độ dài liên kết hóa học (0,111 nm) cho thấy sự hiện diện của liên kết ba phần nào đó. Phân tử này có momen lưỡng cực nhỏ (0,112 Debye hoặc 3,74x10⁻¹⁹ C.m) và thường được biểu diễn qua 3 cấu trúc cộng hưởng.
Chú ý rằng quy tắc octet (quy tắc bát tử) bị vi phạm đối với nguyên tử carbon trong hai cấu trúc hiển thị bên phải.
Nó thể hiện tính khử trong một số phản ứng với các oxide kim loại có hoạt tính hóa học thấp ở nhiệt độ cao, ví dụ như oxide đồng (II), theo phản ứng sau:
Kim loại nickel tạo thành hợp chất dễ bay hơi với CO, được gọi là nickel carbonyl. Carbonyl này phân hủy nhanh chóng trở lại thành kim loại và khí CO, và được sử dụng để tinh chế nickel.
Nhiều kim loại khác cũng có khả năng tạo phức hợp carbonyl với các liên kết cộng hóa trị với carbon monoxide. Những phức chất này có thể được tổng hợp bằng nhiều phương pháp khác nhau, chẳng hạn như đun sôi rutheni triclorua với triphenyl photphin trong methoxyethanol (hoặc DMF) để tạo ra phức chất [RuHCl(CO)(PPh3)3]. Nickel carbonyl đặc biệt vì có thể được tạo ra bằng cách kết hợp trực tiếp carbon monoxide và nickel ở nhiệt độ phòng.
Trong nickel carbonyl và các carbonyl khác, cặp electron trên nguyên tử carbon liên kết với kim loại. Trong trường hợp này, carbon monoxide được gọi là nhóm carbonyl.
Carbon monoxide phản ứng với metanol dưới sự xúc tác của rodi để tạo ra axit axetic theo quy trình Monsanto, phương pháp phổ biến nhất trong sản xuất axit axetic công nghiệp.
Ứng dụng
Sản xuất axit axetic, nhiên liệu, chất khử trong ngành thép, và nhiều ứng dụng khác.
Carbon monoxide trong khí quyển
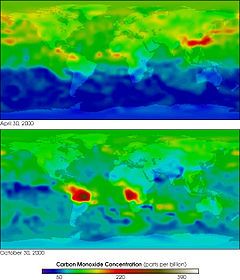
Carbon monoxide gây ra hiệu ứng bức xạ gián tiếp bằng cách làm tăng nồng độ methane và ozone ở tầng đối lưu thông qua phản ứng hóa học với các thành phần khí quyển khác (như gốc hydroxyl, OH), nếu không có thì các thành phần này có thể bị tiêu diệt. Carbon monoxide hình thành khi các nhiên liệu chứa carbon bị đốt cháy không hoàn toàn và cuối cùng được oxy hóa thành carbon dioxide qua các quá trình tự nhiên trong khí quyển. Nồng độ carbon monoxide thay đổi theo không gian và tồn tại ngắn hạn trong khí quyển.
Các liên kết ngoài
- Thẻ an toàn hóa chất quốc tế số 0023
- Hướng dẫn nhanh của NIOSH về các nguy cơ hóa chất
- Ủy ban hóa chất châu Âu
- CID 281 trên PubChem
- Cơ sở dữ liệu khí thải ô nhiễm của Úc - National Pollutant Inventory
| Tiêu đề chuẩn |
|
|---|
Oxide | |
|---|---|
| Số oxy hóa hỗn hợp |
|
| Số oxy hóa +1 |
|
| Số oxy hóa +2 |
|
| Số oxy hóa +3 |
|
| Số oxy hóa +4 |
|
| Số oxy hóa +5 |
|
| Số oxy hóa +6 |
|
| Số oxy hóa +7 |
|
| Số oxy hóa +8 |
|
| Có liên quan |
|
Carbon sắp xếp theo số oxy hóa. Thể loại:oxide | |
Hợp chất oxy |
|---|
Chất dẫn truyền thần kinh |
|---|
