I. Cơ sở lý thuyết về điện phân
1. Thiết kế bình điện phân
Bình điện phân là thiết bị dùng để chứa và thực hiện điện phân chất điện li ở dạng dung dịch hoặc nóng chảy. Bình được làm từ vật liệu không phản ứng với dung dịch hoặc chất điện phân, bên trong có hai điện cực đối diện và được nối với nguồn điện một chiều.
2. Khái niệm về điện phân
- Điện phân là quá trình phản ứng oxi hóa - khử diễn ra trên bề mặt điện cực khi dòng điện một chiều đi qua chất điện li ở trạng thái nóng chảy hoặc dung dịch.
- Điện phân là phương pháp sử dụng điện năng để kích thích các biến đổi hóa học.
- Trong quá trình điện phân, cation di chuyển về cực âm (catot) và anion di chuyển về cực dương (anot), nơi các phản ứng trao đổi electron diễn ra trên các điện cực.
- Các loại điện phân bao gồm: điện phân chất điện li ở trạng thái nóng chảy, điện phân dung dịch điện li với điện cực trơ, và điện phân với điện cực không trơ.
3. Điện phân các chất điện li
a) Điện phân các chất điện li ở trạng thái nóng chảy
Trong thực tế, người ta thường thực hiện điện phân các hợp chất nóng chảy như muối, bazơ, hoặc oxit của các kim loại có tính khử mạnh như Li, Na, K, Ba, Ca, Mg, Al để thu được các kim loại nguyên chất từ hợp chất tương ứng.
Ví dụ: Điện phân Al2O3 nóng chảy có chứa criolit (Na3AlF6)
Al2O3 (nóng chảy) → 2Al3+ + 3O2-
Catot (-) <- Al2O3 → Anot (+)
4Al3+ + 3e → 4Al
3/2O2- → O2 + 4e
Phương trình điện phân: 2Al2O3 → 4Al + 3O2
b) Điện phân dung dịch chất điện li vô cơ trong nước
Khi điện phân dung dịch, ngoài các ion từ chất điện li, còn có các ion H+ và OH- từ nước. Vì vậy, việc xác định sản phẩm của điện phân trở nên phức tạp hơn. Các sản phẩm thu được sẽ phụ thuộc vào tính khử và tính oxi hóa của các ion trong bình điện phân.
Để giải quyết vấn đề này, cần dựa vào các giá trị của các cặp oxi hóa - khử. Trên catot, quá trình khử xảy ra, vì vậy dạng oxi hóa có giá trị lớn hơn sẽ bị khử trước. Ngược lại, trên anot, dạng khử của cặp có giá trị oxi hóa - khử nhỏ nhất sẽ bị oxi hóa trước.
Ví dụ: Điện phân dung dịch CuCl với anot trơ có thể được mô tả như sau:
Catot (-) <- CuCl → Anot (+)
Cu2+ + 2e → Cu 2Cl- → Cl2 + 2e
→ Phương trình điện phân là: CuCl2 → Cu + Cl2
4. Các loại bài toán điện phân thường gặp
- Dạng 1: Tính thời gian điện phân khi đã biết cường độ dòng điện (I) và số mol
Phương pháp giải:
+ Xác định các phương trình điện phân có thể xảy ra (không cần vẽ sơ đồ điện phân)
+ Xác định các sản phẩm tạo ra ở từng điện cực
+ Sử dụng tỷ lệ giống như trong các phương trình hóa học thông thường để tính số mol của sản phẩm
+ Áp dụng công thức Faraday để tính thời gian dựa trên số mol sản phẩm ở các điện cực hoặc số mol electron trao đổi
- Dạng 2: Khi biết thời gian, tính lượng chất tạo thành ở điện cực (hoặc lượng chất tham gia điện phân)
Phương pháp giải:
+ Từ số mol chất đã biết và thời gian, tính toán số mol electron tương ứng
+ Liệt kê từng quá trình nhận và nhường electron, sau đó đối chiếu với số mol electron để xác định giai đoạn điện phân
+ Dựa trên các quá trình đã xác định, tính toán lượng chất đã được điện phân hoặc lượng sản phẩm thu được
II. Điện phân NaCl nóng chảy với điện cực trơ ở Catot sẽ thu được gì?
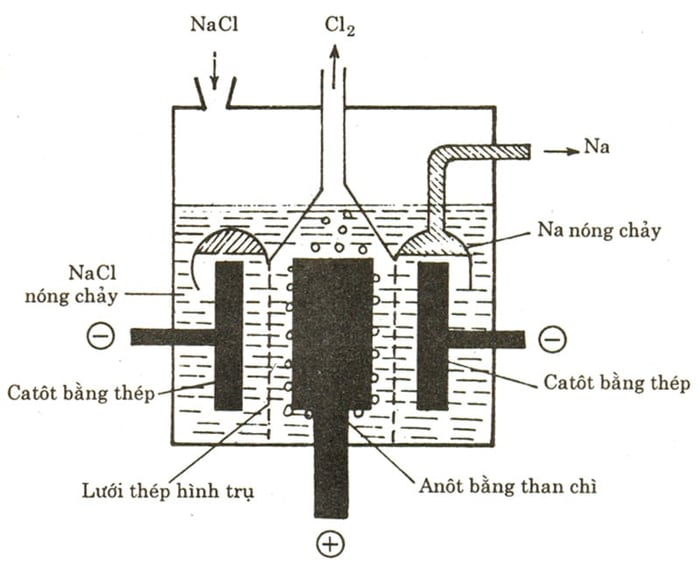
Điện phân NaCl nóng chảy có thể được minh họa bằng sơ đồ sau:
Catot (-) <- NaCl -> Anot (+)
2/ Na+ + e -> Na 2Cl- -> Cl2 + 2e
Dưới tác động của điện trường, các ion âm di chuyển về cực dương, trong khi các ion dương di chuyển về cực âm. Sau đó, Na nhận một electron (cation nhận electron) với quá trình cụ thể như sau:
+ Tại cực dương (anot): xảy ra quá trình oxy hóa:
Cl- (1) -> Cl2 (k) + 2e
+ Tại cực âm (catot): diễn ra quá trình khử
Na+ + 1e -> Na
Phương trình điện phân được biểu diễn như sau:
 2
2Do đó, khi thực hiện điện phân NaCl nóng chảy với điện cực trơ tại catot, chúng ta thu được natri (Na).
Lưu ý: Cần sử dụng màng ngăn để ngăn chặn sự phản ứng của khí Cl2 với Na ở trạng thái nóng chảy, nhằm bảo đảm hiệu suất của quá trình điện phân. Một số phụ gia như Na, KCl có thể giúp giảm nhiệt độ nóng chảy của hệ.
III. Bài tập thực hành
1. Điện phân dung dịch chứa 0,01 mol CuSO4 và 0,12 mol NaCl với điện cực trơ và màng ngăn xốp, dừng lại khi khí bắt đầu thoát ra tại catot. Thể tích khí thu được ở anot tại điều kiện chuẩn là bao nhiêu?
A. 1.344
B. 0.896
C. 1.792
D. 0.448
2. Khi điện phân 10 ml dung dịch AgNO3 0,4M (với điện cực trơ) trong 10 phút 30 giây và dòng điện có cường độ I = 2A, thu được khối lượng Ag là m gam. Nếu phản ứng điện phân đạt hiệu suất 100%, giá trị của m là bao nhiêu?
A. 2,16 gram
B. 1,544 gram
C. 0,432 gram
D. 1,41 gram
3. Khi điện phân V lít dung dịch NaCl 1M và CuSO4 1,8M bằng điện cực trơ cho đến khi nước bắt đầu điện phân ở cả hai cực, khối lượng dung dịch giảm m gam. Dung dịch sau phản ứng có thể hòa tan tối đa 8,84 gam Al2O3. Giá trị của m là bao nhiêu?
A. 34,5
B. 34,8
C. 34,6
D. 34,3
4. Thực hiện điện phân dung dịch hỗn hợp 100g chứa 0,2 mol FeCl3, 0,1 mol CuCl2 và 0,16 mol HCl với điện cực trơ, dừng lại khi khí bắt đầu thoát ra ở cả hai điện cực. Sau đó, cho dung dịch đã điện phân phản ứng hết với 150g dung dịch AgNO3, kết thúc phản ứng thu được 90,08g kết tủa và dung dịch chỉ còn một muối với nồng độ a%. Nồng độ a gần nhất là:
A. 30,5
B. 35,5
C. 33,5
D. 34,5
5. Hòa tan 17,55 gam muối NaCl khan vào 400 ml dung dịch CuSO4 với nồng độ x M để thu được dung dịch X. Khi điện phân dung dịch X bằng điện cực trơ trong t giây, thu được 4,48 lít khí ở anot. Nếu thời gian điện phân tăng gấp đôi (2t giây), tổng thể tích khí thoát ra ở cả hai cực là 9,52 lít. Nhúng thanh Mg vào dung dịch Y sau điện phân, sau khi lấy ra thấy khối lượng thanh Mg tăng thêm m gam. Các khí đều được tính ở điều kiện tiêu chuẩn. Xác định giá trị của x và m.
A. 1,0 và 3,6
B. 0,8 và 4,2
C. 1,0 và 4,2
D. 0,8 và 3,6
6. Điện phân dung dịch chứa m gam hỗn hợp Cu(NO3)2 và KCl với điện cực trơ và màng ngăn xốp, cường độ dòng điện không đổi. Sau thời gian t giây, có 2,688 lít hỗn hợp khí thoát ra ở anot (đktc). Nếu kéo dài thời gian điện phân gấp đôi (2t giây), thể tích khí ở anot sẽ gấp 3 lần thể tích khí ở catot (cùng điều kiện). Đồng thời, khối lượng catot tăng thêm 18,56 gam. Xác định giá trị của m.
7. Khi thực hiện điện phân 200 ml dung dịch CuSO4 với điện cực trơ và cường độ dòng điện 1A, hãy dừng quá trình khi bọt khí xuất hiện ở catot. Để trung hòa dung dịch thu được, cần thêm 100 ml dung dịch NaOH 0,1. Hãy xác định thời gian điện phân và nồng độ mol của dung dịch CuSO4 ban đầu.
8. Điện phân dung dịch chứa 0,2 mol Cu(NO3)2 với điện cực trơ và cường độ dòng điện 2,68A trong t giờ để thu được dung dịch X. Thêm 14,4 gam bột Fe vào X, thu được khí NO (sản phẩm khử duy nhất của N+5) và 13,5 gam chất rắn. Xác định giá trị của t với điều kiện hiệu suất điện phân là 100%.
9. Khi điện phân dung dịch muối sunfat của kim loại hóa trị II bằng điện cực trơ với cường độ dòng điện 3A, sau 1930 giây, khối lượng catot tăng 1,95 gam. Hãy cho biết muối sunfat đã được điện phân là gì?
10. Trong quá trình điện phân dung dịch muối nitrat của kim loại M (hóa trị không đổi) với cường độ dòng điện không đổi, sau t giây, khối lượng dung dịch giảm 6,96 gam và tại catot thu được a gam kim loại M. Sau 2t giây, khối lượng dung dịch giảm 11,78 gam và 0,224 lít khí (đktc) thoát ra. Xác định giá trị của a.
