Giải Khoa học tự nhiên 8 Bài 11: Muối đồng hành cùng học sinh lớp 8, giúp họ nhanh chóng hiểu và áp dụng kiến thức thông qua các bài tập trên sách Kết nối tri thức. (Trang 48, 49, 50, 51, 52).
Ngoài ra, giúp cả thầy cô và học sinh hiểu rõ hơn về các hợp chất thông dụng trong chương II, Bài 11 của sách giáo khoa Khoa học tự nhiên 8. Mời thầy cô và các em cùng tham khảo nội dung dưới đây từ Mytour:
Khái quát
Câu 1: Viết công thức của các muối sau: sulfate kali, hidro sunfat natri, hidrocarbonat natri, clorua natri, nitrat natri, hydrogenphosphat canxi, sulfate magiê, sunfat đồng(II).
Giải đáp:
- Sunfat kali: K2SO4;
- Hidro sunfat natri: NaHSO4;
- Hidrocarbonat natri: NaHCO3;
- Clorua natri: NaCl;
- Nitrat natri: NaNO3;
- Hydrogenphosphat canxi: CaHPO4;
- Sunfat magiê: MgSO4;
- Sunfat đồng(II): CuSO4
Câu 2: Đặt tên cho các muối sau: AlCl3; KCl; Al2(SO4)3; MgSO4; NH4NO3; NaHCO3.
Giải đáp:
- AlCl3: nhôm clorua;
- KCl: kali clorua;
- Al2(SO4)3: nhôm sunfat;
- MgSO4: magiê sunfat;
- NH4NO3: amoniac nitrat;
- NaHCO3: natri hydrogencarbonat.
Câu 3: Viết phương trình hoá học của quá trình hình thành muối KCl và MgSO4.
Giải đáp:
- Các phương trình hoá học sau đây miêu tả quá trình tạo ra muối KCl:
2K + 2HCl → 2KCl + H2
KOH + HCl → KCl + H2O
K2O + 2HCl → 2KCl + H2O
K2CO3 + 2HCl → 2KCl + CO2 + H2O.
- Các phương trình hoá học sau đây mô tả quá trình hình thành muối MgSO4:
Mg + H2SO4 → MgSO4 + H2
Mg(OH)2+ H2SO4 → MgSO4 + H2O
MgO + H2SO4→ MgSO4 + H2O
MgCO3 + H2SO4 → MgSO4 + CO2 + H2O.
Thuộc tính hóa học
Trong dung dịch, giữa những cặp chất sau đây đã xảy ra phản ứng? Viết phương trình hoá học của các phản ứng đó.
| Na2CO3 | KCl | Na2SO4 | NaNO3 | |
| Ca(NO3)2 | ? | ? | ? | ? |
| BaCl2 | ? | ? | ? | ? |
| HNO3 | ? | ? | ? | ? |
Giải đáp:
| Na2CO3 | KCl | Na2SO4 | NaNO3 | |
| Ca(NO3)2 | × | - | × | - |
| BaCl2 | × | - | × | - |
| HNO3 | × | - | - | - |
(“×”: có phản ứng xảy ra; “-”: không có phản ứng)
Công thức hoá học:
Ca(NO3)2 + Na2CO3→ CaCO3 + 2NaNO3
Ca(NO3)2 + Na2SO4 → CaSO4 + 2NaNO3
BaCl2 + Na2CO3 → BaCO3 + 2NaCl
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
2HNO3 + Na2CO3 → 2NaNO3 + CO2+ H2O.
Liên hệ giữa các hợp chất vô cơ
Tính chất hoá học của các hợp chất vô cơ được biểu diễn trong sơ đồ dưới đây:
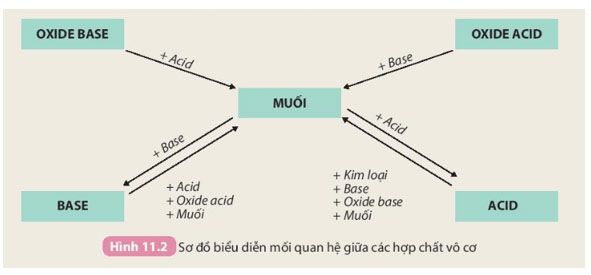
Dựa vào sơ đồ Hình 11.2 và mô tả tính chất của oxide, acid, base. Viết phương trình hoá học minh hoạ.
Giải đáp:
- Tính chất của oxide:
+ Oxide có tính kiềm tác dụng với acid tạo thành muối và nước. Ví dụ:
CaO + 2HCl → CaCl2 + H2O.
+ Oxide axit tác dụng với dung dịch kiềm tạo thành muối và nước. Ví dụ:
SO2 + 2NaOH → Na2SO3 + H2O.
- Tính chất của axit:
+ Tác dụng với kim loại tạo thành muối và khí. Ví dụ:
Fe + 2HCl → FeCl2 + H2.
+ Phản ứng với kiềm tạo thành muối và nước. Ví dụ:
HCl + NaOH → NaCl + H2O.
+ Phản ứng với oxide kiềm tạo thành muối và nước. Ví dụ:
H2SO4 + Na2O → Na2SO4 + H2O.
+ Phản ứng với muối tạo thành muối mới và axit mới. Ví dụ:
H2SO4 + BaCl2 → BaSO4 + 2HCl.
- Tính chất của kiềm:
+ Phản ứng với axit tạo thành muối và nước. Ví dụ:
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
+ Phản ứng với oxide axit tạo thành muối và nước. Ví dụ:
Ca(OH)2 + CO2 → CaCO3 + H2O.
+ Phản ứng với dung dịch muối tạo thành muối mới và kiềm mới. Ví dụ:
Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH.
