Liên kết đồng hóa trị, còn được gọi là liên kết phân tử, là loại liên kết hóa học hình thành khi các nguyên tử chia sẻ một hoặc nhiều cặp electron. Những cặp electron này được gọi là cặp electron chia sẻ. Sự cân bằng giữa lực hút và lực đẩy giữa các nguyên tử trong quá trình chia sẻ electron tạo nên liên kết đồng hóa trị. Việc chia sẻ electron giúp các nguyên tử đạt được cấu hình electron ổn định hơn.
Liên kết đồng hóa trị bao gồm nhiều loại, như liên kết σ, liên kết π, và liên kết kim loại. Thuật ngữ liên kết đồng hóa trị lần đầu tiên được sử dụng vào năm 1939. Tiền tố 'co-' có nghĩa là cùng nhau, biểu thị việc các nguyên tử chia sẻ 'hóa trị', như đã được trình bày trong thuyết liên kết hóa trị.
Trong phân tử H
2, nguyên tử hydro chia sẻ hai electron qua liên kết đồng hóa trị. Liên kết này mạnh nhất khi các nguyên tử có độ âm điện tương đương. Do đó, liên kết đồng hóa trị không nhất thiết phải xảy ra giữa hai nguyên tử của cùng một nguyên tố, chỉ cần độ âm điện của chúng gần giống nhau. Khi nhiều hơn hai nguyên tử chia sẻ electron, liên kết được coi là không ổn định.
Lịch sử
Thuật ngữ covalence lần đầu được sử dụng vào năm 1919 bởi Irving Langmuir trong bài viết của Tạp chí Hiệp hội Hóa học Hoa Kỳ, với tiêu đề 'Sự sắp xếp của các electron trong nguyên tử và phân tử.' Langmuir định nghĩa covalence là số lượng cặp electron mà một nguyên tử chia sẻ với các nguyên tử xung quanh nó ('we shall denote by the term covalence the number of pairs of electrons that a given atom shares with its neighbors').
Ý tưởng về liên kết cộng hóa trị có thể đã được phát hiện sớm hơn. Vào năm 1916, Gilbert N. Lewis đã mô tả cách các cặp electron được chia sẻ giữa các nguyên tử. Ông phát triển ký hiệu Lewis hoặc dấu chấm electron, trong đó các electron hóa trị được biểu thị dưới dạng các chấm xung quanh ký hiệu nguyên tử. Các cặp electron giữa các nguyên tử đại diện cho liên kết cộng hóa trị. Nhiều cặp electron thể hiện các liên kết kép hoặc ba. Một phương pháp thay thế, không được thể hiện ở đây, là dùng các gạch thẳng để biểu diễn các liên kết.
Lewis cho rằng một nguyên tử tạo đủ liên kết cộng hóa trị để hoàn thành lớp vỏ ngoài cùng. Trong hình, nguyên tử carbon có hóa trị bốn, nên được bao quanh bởi tám electron (quy tắc bát tử), bao gồm bốn electron của chính nó và bốn electron từ các nguyên tử hydro liên kết. Mỗi nguyên tử hydro có hóa trị một, bao quanh bởi hai electron (quy tắc đôi) - một electron của nó cộng với một electron từ nguyên tử carbon. Số lượng electron phù hợp với số lượng cần thiết để lấp đầy lớp vỏ ngoài theo thuyết lượng tử; lớp ngoài cùng của nguyên tử carbon là n = 2, có thể chứa tám electron, trong khi lớp ngoài cùng của nguyên tử hydro là n = 1, chỉ chứa hai electron.
Mặc dù khái niệm về các cặp electron dùng chung cung cấp một cái nhìn định tính hữu ích về liên kết cộng hóa trị, nhưng để hiểu rõ hơn về bản chất và dự đoán cấu trúc cũng như tính chất của các phân tử đơn giản, cần phải áp dụng cơ học lượng tử. Walter Heitler và Fritz London là những người đầu tiên áp dụng cơ học lượng tử để giải thích thành công liên kết hóa học (như trong phân tử hydro) vào năm 1927. Họ dựa trên mô hình liên kết hóa trị, giả định rằng liên kết hóa học hình thành khi các orbital nguyên tử của các nguyên tử tham gia chồng chéo tốt với nhau.
Các loại liên kết cộng hóa trị
Các orbital nguyên tử (ngoài orbital s) có các đặc tính định hướng khác nhau, dẫn đến sự hình thành các loại liên kết khác nhau. Liên kết sigma (σ) là loại liên kết cộng hóa trị mạnh nhất, nhờ vào sự chồng chéo của orbital giữa hai nguyên tử khác nhau. Liên kết đơn thường là liên kết σ. Liên kết pi (π) yếu hơn, được hình thành do sự chồng chéo của các orbital p (hoặc d). Một liên kết đôi giữa hai nguyên tử bao gồm một liên kết σ và một liên kết π, trong khi liên kết ba bao gồm một liên kết σ và hai liên kết π.
Liên kết cộng hóa trị còn chịu ảnh hưởng bởi độ âm điện của các nguyên tử tham gia, điều này quyết định sự phân cực của liên kết. Hai nguyên tử có độ âm điện tương đương tạo ra liên kết cộng hóa trị không phân cực, chẳng hạn như H-H. Ngược lại, nếu liên kết không cân bằng sẽ tạo ra liên kết phân cực, như trong trường hợp H-Cl. Tuy nhiên, sự phân cực còn phụ thuộc vào hình học không đối xứng, hoặc các lưỡng cực khác có thể bị hủy bỏ, tạo nên phân tử không phân cực.
Cấu trúc cộng hóa trị
Có nhiều kiểu cấu trúc liên kết cộng hóa trị, bao gồm cấu trúc phân tử đơn, phân tử đa phân tử, đại phân tử và cấu trúc cộng hóa trị khổng lồ. Cấu trúc phân tử đơn có các liên kết mạnh mẽ giữa các nguyên tử, nhưng giữa các phân tử có lực hút không đáng kể, như trong khí HCl, SO2, CO2, và CH4. Trong cấu trúc phân tử, lực hút yếu hơn, dẫn đến các chất lỏng với nhiệt độ sôi thấp (như ethanol) và các chất rắn có nhiệt độ nóng chảy thấp (như iod và CO2 rắn). Cấu trúc đại phân tử chứa nhiều nguyên tử liên kết với nhau qua liên kết cộng hóa trị, ví dụ như polymer tổng hợp (polyethylene, nylon) và polymer sinh học (protein, tinh bột). Cấu trúc mạng lưới cộng hóa trị (cấu trúc khổng lồ) có nhiều nguyên tử liên kết theo lớp (như than chì) hoặc ba chiều (như kim cương, thạch anh), với nhiệt độ nóng chảy và sôi cao, thường giòn và có điện trở suất cao. Các nguyên tố có độ âm điện cao và khả năng hình thành nhiều liên kết đôi hoặc ba thường tạo ra các cấu trúc đại phân tử như vậy.
Các liên kết một và ba electron
Các liên kết với một hoặc ba electron xuất hiện trong các gốc tự do với số lượng electron bất thường. Ví dụ đơn giản nhất của liên kết một electron là liên kết trong cation hydro, H
2. Các liên kết một electron có năng lượng bằng một nửa của liên kết hai electron, do đó còn được gọi là 'nửa liên kết'. Tuy nhiên, có ngoại lệ: trong trường hợp của dilithium, liên kết một electron Li
2 lại mạnh hơn liên kết hai electron Li2. Điều này có thể được giải thích bằng thuật ngữ lai hóa và hiệu ứng dưới lớp vỏ.
Một ví dụ đơn giản về liên kết ba electron là liên kết trong cation helium dimer, He
2. Đây được xem là 'nửa liên kết' vì nó chia sẻ chỉ một electron (thay vì hai); trong thuật ngữ orbital phân tử, electron thứ ba là một orbital phản liên kết, làm giảm một nửa liên kết hình thành bởi hai electron kia. Một ví dụ khác về phân tử chứa liên kết ba electron, cộng với liên kết hai electron, là nitơ monoxide, NO. Phân tử oxy, O2 cũng có thể được coi là có hai liên kết ba electron và hai electron, giải thích cho tính từ tính của nó và trật tự liên kết là hai. Các phân tử như chlor dioxide, brom dioxide và iod dioxide cũng chứa liên kết ba electron.
Các phân tử với liên kết có số lượng electron bất thường thường thể hiện tính phản ứng cao. Những liên kết này chỉ giữ được sự ổn định giữa các nguyên tố có độ âm điện tương đồng.
Cộng hưởng
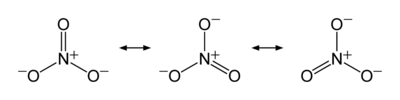
Trong một số trường hợp, cấu trúc Lewis đơn giản không đủ để mô tả chính xác cấu trúc electron của phân tử, do đó cần xem xét sự cộng hưởng giữa các cấu trúc. Các nguyên tử trong các phân tử này có thể liên kết khác nhau trong các cấu trúc khác nhau (liên kết đơn trong một cấu trúc, liên kết đôi trong một cấu trúc khác, hoặc không có liên kết nào), dẫn đến bậc liên kết trung bình không nguyên. Ion nitrat là một ví dụ điển hình với ba cấu trúc tương đương. Liên kết giữa nitơ và mỗi oxy là một liên kết đôi trong một cấu trúc và một liên kết đơn trong hai cấu trúc còn lại, do đó bậc liên kết trung bình trong mỗi liên kết N–O là 2 + 1 + 1/3 = 4/3.
Thơm
Trong hóa học hữu cơ, các phân tử vòng phẳng tuân theo quy tắc Hückel, với số lượng electron π phù hợp với công thức 4n + 2 (n là số nguyên), sẽ đạt được sự ổn định và đối xứng cao. Benzen, hợp chất thơm đầu tiên, chứa 6 electron liên kết π (n = 1, 4n + 2 = 6). Các electron này phân bố trên ba orbital phân tử đồng nhất (theo thuyết orbital phân tử) hoặc tạo thành các liên kết π trong hai cấu trúc cộng hưởng tuyến tính (theo thuyết liên kết hóa trị), hình thành một cấu trúc lục giác thể hiện tính ổn định cao hơn so với giả thuyết 1,3,5-cyclohexatriene.
Đối với các hợp chất thơm dị vòng và benzen thay thế, sự khác biệt về độ âm điện giữa các phần của vòng có thể ảnh hưởng lớn đến hoạt động hóa học của các liên kết thơm trong vòng, nếu không thì chúng thường tương đương nhau.
Siêu hóa trị
Một số phân tử đặc biệt như xenon difluoride và lưu huỳnh hexafluoride có số phối trí vượt quá giới hạn quy tắc bát tử. Điều này được giải thích bằng mô hình liên kết 3c–4e, trong đó phân tử được mô tả qua các orbital phân tử không liên kết và sự cộng hưởng ion-covalent theo thuyết liên kết hóa trị.
Thiếu electron
Trong liên kết 3c–2e, ba nguyên tử cùng chia sẻ hai electron trong một liên kết. Loại liên kết này thường thấy trong các hợp chất thiếu electron như diborane. Mỗi liên kết (với hai liên kết như vậy trong diborane) bao gồm một cặp electron nối các nguyên tử bor, tạo hình dạng giống như hình trái chuối, với một proton (hạt nhân của một nguyên tử hydro) nằm giữa liên kết, chia sẻ electron với cả hai nguyên tử bor. Trong một số nhóm hóa học cụ thể, liên kết gọi là liên kết 4c–2e cũng được đề cập.
