Liên kết hóa trị phối hợp, còn gọi là liên kết hóa trị đồng phối hợp, liên kết cho–nhận hóa trị, liên kết phối hợp hay liên kết hai cực (tiếng Anh: coordinate covalent bond, dative bond, dipolar bond, hoặc coordinate bond) là một dạng liên kết hóa trị với hai tâm và hai electron (2c-2e), trong đó hai electron dùng chung chỉ đến từ một nguyên tử duy nhất. Độ bền của liên kết này tương đương với liên kết hóa trị thông thường. Liên kết giữa các ion kim loại và các phối tử thuộc về loại tương tác này, trung tâm của lý thuyết acid-base Lewis.
Liên kết hóa trị phối hợp thường xuất hiện trong các phức chất.
Ví dụ
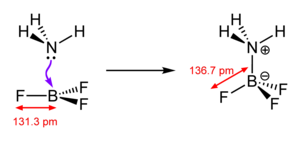
Liên kết hóa trị phối hợp rất phổ biến. Trong tất cả các phức chất nước kim loại [M(H2O)n], liên kết giữa phân tử nước và cation kim loại được mô tả là liên kết hóa trị phối hợp. Tương tác giữa kim loại và phối tử trong hầu hết các hợp chất cơ kim loại và hợp chất phối trí tương tự nhau.
Thuật ngữ liên kết hai cực được dùng trong hóa hữu cơ để chỉ các hợp chất như amin oxide, trong đó cấu trúc electron có thể được mô tả như amin cơ bản 'tặng' hai electron cho nguyên tử oxy.
- R
3N → O
Mũi tên → chỉ ra rằng cả hai electron trong liên kết đều đến từ nhóm amin. Trong một liên kết hóa trị tiêu chuẩn, mỗi nguyên tử cung cấp một electron. Do đó, một cách mô tả khác là amin nhường một electron cho nguyên tử oxy, và electron này kết hợp với electron chưa ghép cặp còn lại trên nguyên tử nitơ, để tạo thành liên kết hóa trị tiêu chuẩn. Quá trình chuyển electron từ nitơ sang oxy tạo ra các điện tích hình thức, vì vậy cấu trúc electron cũng có thể được mô tả là:
- R
3N
O
Liên kết tham khảo
- Chemguide
Liên kết hóa học | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
phân tử (mạnh) |
| ||||||||||||||
phân tử (yếu) |
| ||||||||||||||
