
Trong hóa học, liên kết π (hay liên kết pi) là một loại liên kết cộng hóa trị được hình thành khi hai thùy của obitan nguyên tử chồng lấp với hai thùy của obitan khác trong liên kết, tạo nên sự chồng lấp bên của các obitan. Chỉ một mặt phẳng nút của obitan đi qua cả hai hạt nhân tham gia liên kết.
Ký hiệu Hy Lạp π trong tên của liên kết này biểu thị các obitan p, vì sự đối xứng của các obitan trong liên kết π cũng giống như sự đối xứng của các obitan dọc theo trục liên kết. Các obitan p thường tham gia vào loại liên kết này, tuy nhiên, obitan d cũng có thể tham gia, tạo nên cơ sở cho liên kết bội kim loại.
Liên kết π thường yếu hơn liên kết sigma vì electron (mang điện âm) phân bố xa hạt nhân nguyên tử (mang điện dương), yêu cầu nhiều năng lượng hơn. Liên kết đôi C-C bao gồm một liên kết sigma và một liên kết π, có năng lượng liên kết chỉ bằng một nửa của liên kết đơn C-C, cho thấy rằng một liên kết π yếu hơn trong việc gia tăng độ ổn định so với liên kết sigma. Từ góc độ cơ học lượng tử, độ yếu của liên kết này có thể giải thích bằng sự chồng lấp kém hơn giữa các obitan p do định hướng song song của chúng. Ngược lại, liên kết sigma tạo ra sự chồng lấp lớn hơn tại hạt nhân nguyên tử.
Ngoài liên kết sigma, một cặp nguyên tử có thể liên kết qua liên kết đôi hoặc ba, với một hoặc hai liên kết π tương ứng. Các liên kết π hình thành từ sự chồng lấp của các obitan nguyên tử qua hai vùng chồng lấp. Chúng thường kéo dài trong không gian hơn so với liên kết sigma và các electron trong các liên kết π thường được gọi là electron π. Các phân tử liên kết qua liên kết π không thể xoay quanh liên kết mà không làm phá vỡ liên kết π, vì điều này phá hủy sự định hướng song song của các obitan p cấu thành.
Các liên kết bội
Liên kết đôi thường bao gồm một liên kết sigma và một liên kết π, như liên kết đôi C=C trong etilen. Liên kết ba, chẳng hạn như trong acetylen, bao gồm một liên kết sigma và hai liên kết π nằm trong hai mặt phẳng vuông góc với trục liên kết. Tối đa có thể có hai liên kết π giữa hai nguyên tử, trong khi liên kết bốn rất hiếm và chỉ hình thành giữa các nguyên tử kim loại chuyển tiếp, bao gồm một liên kết sigma, hai liên kết π và một liên kết delta.
Mặc dù liên kết π yếu hơn liên kết sigma, nó là phần cấu thành của các liên kết bội cùng với liên kết sigma. Sự kết hợp của liên kết π và sigma tạo ra liên kết bội mạnh hơn bất kỳ liên kết đơn nào. Sức mạnh gia tăng của liên kết bội so với liên kết đơn có thể được quan sát qua sự giảm độ dài liên kết. Ví dụ, trong hóa học hữu cơ, độ dài liên kết cacbon–cacbon là khoảng 154 pm trong etan, 134 pm trong etylen, và 120 pm trong acetylen. Sự tồn tại của nhiều liên kết làm cho liên kết ngắn hơn và mạnh mẽ hơn.

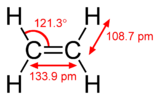
| etan (1 liên kết σ) | etilen (1 liên kết σ + 1 liên kết π) | acetylen (1 liên kết σ + 2 liên kết π) |
Các trường hợp đặc biệt
Các liên kết π không nhất thiết phải gắn kết các đôi nguyên tử mà có thể kết hợp với liên kết sigma.
Trong một số phức chất kim loại, sự tương tác π giữa một nguyên tử kim loại và các obitan p đối liên kết của ankin (alkyne) và anken (alkene) dẫn đến hình thành các liên kết π.
Có những trường hợp trong liên kết bội giữa hai nguyên tử, toàn bộ chỉ là các liên kết π. Ví dụ như trong diiron hexacarbonyl (Fe2(CO)6), dicarbon (C2) và borane B2H2. Trong các hợp chất này, liên kết trung tâm hoàn toàn bao gồm các liên kết π, và để đạt được sự xen phủ tối đa, các khoảng cách liên kết cần phải ngắn hơn bình thường.
- Liên kết hóa học
- Liên kết delta
- Liên kết sigma
- Tương tác thơm
- Hình học phân tử
- Liên kết π ngược
- Tương tác π
Liên kết hóa học | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
phân tử (mạnh) |
| ||||||||||||||
phân tử (yếu) |
| ||||||||||||||
