



| Magnesi carbonat | |
|---|---|
| Tổng quan | |
| Danh pháp IUPAC | magnesium carbonate |
| Tên khác | Magnesit Barring tonite (ngậm 2 nước) Lansfordite (ngậm 5 nước) |
| Công thức phân tử | MgCO3 |
| Phân tử gam | 84,3139 g/mol |
| Biểu hiện | rắn trắng, độc tính thấp |
| Số CAS | 546-93-0 |
| Thuộc tính | |
| Tỷ trọng và pha | chưa rõ |
| Độ hòa tan trong nước | 0,0012 mol/lít (25C, Khan) 0,375 g/100 ml (20C, pentahydrat) |
| Nhiệt độ nóng chảy | 540C |
| Điểm sôi | Chưa làm rõ |
| pKb | 10,04 |
| Độ nhớt | chưa làm rõ |
| Khác | |
| MSDS | ICSC 0.969 |
| Các nguy hiểm chính | Không có, độc tính thấp |
| NFPA 704 | |
| Điểm bắt lửa | không cháy |
| Rủi ro/An toàn | chưa có |
| Số RTECS | chưa biết |
| Dữ liệu hóa chất bổ sung | |
| Cấu trúc & thuộc tính | mạng lưới tam giác 1,717 (KHAN) 1,458 (Dihydrate) 1,412 (Trihydrate) |
| Các hợp chất liên quan | |
| Các hợp chất tương tự | Beryli carbonat Calci carbonat Stronti carbonat Bari carbonat |
| Các hợp chất liên quan | Magnesi Hydrocarbonat |
| Ngoại trừ có thông báo khác, các dữ liệu được lấy ở 25 °C, 100 kPa Thông tin về sự phủ nhận và tham chiếu | |
Magnesi carbonat là một hợp chất vô cơ với công thức hóa học MgCO3. Thường xuất hiện dưới dạng chất rắn màu trắng, không có hình dạng cụ thể và có cấu trúc vụn bở. Trong tự nhiên, nó tồn tại dưới dạng muối khoáng ngậm nước và được sử dụng rộng rãi trong nhiều lĩnh vực khoa học và đời sống.

Những dạng tự nhiên của nó
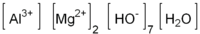
Magnesi carbonat xuất hiện phổ biến trong tự nhiên dưới dạng muối khan gọi là magnesit (MgCO3 khan) và các dạng hydrat như dihydrat, trihydrat, penta hydrat. Ví dụ, Barringtonite (MgCO3.2H2O), Nesequehonite (MgCO3.3H2O) và Lansfordite (MgCO3.5H2O) đều là các khoáng sản chứa muối carbonat của magnesi. Magnesit khan có màu trắng, cấu trúc tinh thể hình tam giác, không tan trong nước, dung dịch aceton, hay nước amonia, nhưng phản ứng mạnh với acid, giải phóng khí CO2 (carbon dioxide). Các muối dihydrat có liên kết tam diện (triclinic), trong khi trihydrat có liên kết đơn diện (monoclinic).
Sản xuất
Dù magnesi carbonat có thể dễ dàng thu được từ khoáng sản magnesit hoặc các muối hydrat trihydrat (MgCO3.3H2O), trong sản xuất công nghiệp thường dùng phương pháp trộn hỗn hợp ion magnesi và ion carbonat trong môi trường khí carbon dioxide.
Magnesi carbonat cũng có thể được tổng hợp bằng cách nén khí carbon dioxide ở áp suất từ 3,5 đến 5 atm qua hợp chất magnesi Hydroxide dạng bùn, dưới nhiệt độ dưới 50°C. Sản phẩm thu được là magnesi Hydrocarbonat, hay còn gọi là magnesi bicabonat [Mg(HCO3)2]
- Mg(OH)2 + 2CO2 → Mg(HCO3)2
Sản phẩm sau khi lọc được sấy khô trong môi trường chân không, cho ra magnesi carbonat ngậm nước.
- Mg + 2HCO3 → MgCO3 + CO2 + H2O
Sử dụng
Magnesit và các dạng khoáng sản của magnesi carbonat được dùng để sản xuất magnesi kim loại, gạch chịu lửa, vật liệu chống cháy, mỹ phẩm và kem đánh răng. Ngoài ra, nó còn là phụ gia trong sản xuất cao su, chất dẻo, chất hút ẩm, thuốc nhuận tràng và giữ màu thực phẩm. Magnesi carbonat tinh khiết cao còn được sử dụng như chất kháng acid và phụ gia muối để nâng cao nhiệt độ nóng chảy.
Do muối magnesi carbonat ít độc và có khả năng ngậm nước, năm 1911, MgCO3 được thêm vào muối để cải thiện khả năng bảo quản. Công ty Morton Salt thậm chí quảng cáo với khẩu hiệu 'Khi trời đổ mưa rào' (When it rains it pours) để nhấn mạnh rằng muối của họ có pha thêm MgCO3, không bị vón cục khi ẩm ướt.

Magnesi carbonat, hay còn gọi là phấn rôm, được dùng để làm khô mồ hôi tay cho các vận động viên leo núi, thể dục dụng cụ và cử tạ.
Magnesi carbonat cũng được thêm vào kem đánh răng để làm trắng răng. Khi kết hợp với hydrogen peroxide, nó tạo ra một lớp phủ bảo vệ và làm trắng bề mặt răng.
Magnesi carbonat còn được sử dụng như phấn trang điểm hoặc thành phần trong kem dưỡng da. Nó có tác dụng hút ẩm nhẹ, làm se da, và giúp da trở nên mịn màng, phù hợp cho cả da thường lẫn da khô.
Phụ gia thực phẩm
Trong ngành thực phẩm, magnesi carbonat là thành phần của phụ gia thực phẩm có ký hiệu E504, có thể gây tác dụng phụ như là một loại thuốc nhuận trường khi sử dụng với liều cao.
Độc tính
Magnesi carbonat cơ bản không gây độc hại cho con người. Tuy nhiên, việc sử dụng quá liều có thể dẫn đến trầm cảm hệ thần kinh trung ương và các vấn đề về tim mạch. Nó cũng có thể gây ảnh hưởng đến da, mắt và có thể kích ứng đường hô hấp và tiêu hóa nếu nuốt hoặc hít phải.
- Ảnh hưởng của các thành phần độ cứng đến độc tính cấp tính của cadmium đối với cá hồi suối
- Ảnh hưởng của muối canxi và magnesi đối với khả năng gây ung thư của nickel subsulfide ở chuột Fischer
- Vai trò của Silica trong việc chống lại độc tính gây ra bởi magnesia
- Khả năng sẵn có của Mangan và Sắt bị ảnh hưởng bởi việc bón canxi và magnesi carbonat cho đất
- Thẻ an toàn hóa chất quốc tế 0969
- Cơ sở dữ liệu chuẩn NIST
- Patnaik, Pradyot (2003). Sổ tay Hóa chất vô cơ. New York, McGraw Hill.
- Trotman-Dickenson, A.F '(biên tập)' (1973). Tổng quan Hóa học vô cơ. Oxford, Pergamon Press.
