
Hóa học (viết tắt là hóa) (Tiếng Anh: chemistry) là một lĩnh vực của khoa học tự nhiên chuyên nghiên cứu thành phần, cấu trúc, tính chất và sự biến đổi của vật chất. Các chủ đề chính trong hóa học bao gồm nguyên tố, hợp chất, nguyên tử, phân tử và các phản ứng hóa học.
Hóa học thường được gọi là 'khoa học trung gian' vì nó kết nối các lĩnh vực khoa học tự nhiên khác như vật lý, địa chất và sinh học.
Nguồn gốc của từ
Tên gọi hóa học trong tiếng Việt bắt nguồn từ từ 化學 trong tiếng Trung, với âm Hán Việt là hóa học. Thuật ngữ 化學 hóa học được William Alexander Parsons Martin sáng tạo và lần đầu tiên xuất hiện trong quyển thứ sáu của bộ sách bằng văn ngôn của ông, có tên là 格物入門 Cách vật nhập môn, xuất bản năm Đồng Trị thứ bảy (1868) dưới triều đại nhà Thanh bởi Kinh sư Đồng văn quán (京師同文館). Quyển sách 格物入門 Cách vật nhập môn bao gồm bảy phần: 水學 Thủy học (nước), 氣學 Khí học (khí), 火學 Hỏa học (lửa), 電學 Điện học, 力學 Lực học, 化學 Hóa học, 算學 Toán học.
Hóa học lần đầu tiên được đưa vào Việt Nam qua miền Nam thuộc Pháp trong thời kỳ Đệ Nhị Đế chế Pháp và đã được giảng dạy rộng rãi ở miền Nam Việt Nam. Do đó, nhiều khái niệm hóa học hiện nay vẫn còn mang ảnh hưởng từ thời kỳ này, như từ acide (axit), aldehyde (anđêhit) và cách sắp xếp các phần định chức trong hệ thống danh pháp,...
Quá trình lịch sử
Hóa học có nguồn gốc từ giả kim thuật, một lĩnh vực đã được thực hành từ hàng nghìn năm trước tại Trung Quốc, Châu Âu và Ấn Độ.

Giả kim thuật là một lĩnh vực nghiên cứu về vật chất, tuy nhiên, thế giới của các nhà giả kim thuật dựa chủ yếu trên kinh nghiệm thực tiễn và các công thức thực hành thay vì nghiên cứu khoa học. Mục tiêu của họ là tìm ra một chất gọi là 'Hòn đá triết học' để biến đổi chì thành vàng. Dù chưa bao giờ thành công trong việc tạo ra hòn đá triết học, các nhà giả kim thuật đã thực hiện nhiều thí nghiệm và phát triển nhiều dụng cụ, một số trong số đó vẫn được sử dụng trong hóa học ngày nay.
Dù không có ai tìm ra được hòn đá triết học, vào thế kỷ 17, khoa giả kim thuật đã được thay thế bởi các phương pháp khoa học. Một phần kiến thức của các nhà giả kim thuật vẫn còn ảnh hưởng đến các nhà hóa học hiện đại, những người dựa vào các kết luận logic từ quan sát thay vì ý tưởng biến chì thành vàng.

Lịch sử hóa học thường được bắt đầu từ khi Robert Boyle tách biệt hóa học khỏi giả kim thuật trong tác phẩm The Skeptical Chemist (Nhà hóa học hoài nghi) vào năm 1661, mặc dù nó cũng được đánh dấu bởi việc Antoine Lavoisier phát hiện ra khí oxy vào năm 1783.
Hóa học đã có những bước tiến lớn và phân hóa mạnh mẽ trong thế kỷ 19. Nghiên cứu của Justus von Liebig về tác động của phân bón đã dẫn đến sự ra đời của hóa học nông nghiệp và đóng góp vào hóa học vô cơ. Cuộc tìm kiếm chất thay thế cho phẩm màu indigo trong nhuộm vải đã đánh dấu bước khởi đầu cho những phát triển đáng kể trong hóa học hữu cơ và dược phẩm. Một cột mốc quan trọng là sự phát minh bảng tuần hoàn nguyên tố của Dmitri Ivanovich Mendeleev và Lothar Meyer. Mendeleev đã dự đoán sự tồn tại và tính chất của các nguyên tố germanium, gallium và scandium vào năm 1870, với gallium được phát hiện vào năm 1875 và có tính chất giống như dự đoán của Mendeleev.
Trong thời kỳ chuyển giao giữa thế kỷ 19 và 20, nghiên cứu hóa học đã tiến xa đến mức các nghiên cứu về cấu trúc nguyên tử không còn nằm trong phạm vi của hóa học mà thuộc về vật lý nguyên tử hoặc vật lý hạt nhân. Dù vậy, những công trình này đã cung cấp cái nhìn sâu sắc quan trọng về sự biến đổi hóa học và các liên kết hóa học. Các khám phá trong vật lý lượng tử, đặc biệt là mô hình quỹ đạo điện tử, đã đóng góp vào sự hiểu biết này.
Các nguyên lý cơ bản của hóa học hiện đại

Mô hình cấu trúc nguyên tử hiện nay dựa trên cơ học lượng tử. Hóa học truyền thống bắt đầu bằng việc nghiên cứu các hạt cơ bản, nguyên tử, phân tử, chất, kim loại, tinh thể và các hợp chất khác của vật chất. Các nghiên cứu có thể thực hiện trong các trạng thái rắn, lỏng hoặc khí, riêng lẻ hoặc trong hỗn hợp. Các phản ứng và biến đổi trong hóa học thường là kết quả của các tương tác giữa nguyên tử, dẫn đến sự tái cấu trúc các liên kết hóa học. Những biến đổi này được nghiên cứu trong các phòng thí nghiệm hóa học.
Phòng thí nghiệm hóa học thường sử dụng nhiều dụng cụ thủy tinh, nhưng những dụng cụ này không phải là yếu tố quan trọng nhất trong hóa học. Rất nhiều thí nghiệm và ứng dụng hóa học có thể được thực hiện mà không cần đến dụng cụ thủy tinh.
Phản ứng hóa học là quá trình biến đổi các chất ban đầu thành một hoặc nhiều chất mới. Sự thay đổi này dựa trên việc sắp xếp lại các electron trong các liên kết hóa học giữa các nguyên tử. Quá trình này có thể được biểu diễn bằng phương trình hóa học, với sự chú trọng vào số lượng nguyên tử ở hai bên của phương trình. Nếu số lượng nguyên tử không khớp nhau, thì đó là phản ứng hạt nhân hoặc sự phân rã phóng xạ. Các phản ứng hóa học và sự thay đổi năng lượng liên quan tuân theo các định luật hóa học cơ bản.
Năng lượng và entropy luôn là những yếu tố quan trọng trong nghiên cứu hóa học. Các chất hóa học được phân loại theo cấu trúc, trạng thái, và thành phần hóa học của chúng, và có thể được phân tích bằng các công cụ như quang phổ và sắc ký. Các nhà khoa học nghiên cứu hóa học được gọi là các nhà hóa học và thường chuyên sâu trong một hoặc nhiều lĩnh vực con. Một số khái niệm cơ bản cần thiết cho nghiên cứu hóa học bao gồm:
Vật chất
Trong hóa học, vật chất được định nghĩa là bất kỳ vật thể nào có khối lượng và thể tích (chiếm không gian) và được cấu thành từ các hạt. Các hạt này có khối lượng tĩnh, mặc dù không phải tất cả đều có khối lượng tĩnh, chẳng hạn như photon. Vật chất có thể là một chất hóa học tinh khiết hoặc một hỗn hợp các chất khác.
Nguyên tử
Nguyên tử là đơn vị cơ bản của hóa học, bao gồm một hạt nhân đặc, chứa các proton dương và neutron không mang điện, xung quanh là một đám mây điện tử. Đám mây này chứa các electron âm, quay quanh hạt nhân. Trong nguyên tử trung hòa điện, số lượng electron và proton cân bằng nhau. Mặc dù hạt nhân rất nhỏ và nặng, một nucleon nặng hơn 1836 lần so với electron, nhưng kích thước của nguyên tử lớn hơn gấp 10000 lần so với kích thước của hạt nhân.
Nguyên tử là thành phần nhỏ nhất giữ các tính chất hóa học của nguyên tố, bao gồm độ âm điện, khả năng ion hóa, trạng thái oxy hóa, số phối trí và các loại liên kết có thể hình thành như liên kết kim loại, ion, và cộng hóa trị.
Nguyên tố
Nguyên tố hóa học là chất tinh khiết chỉ bao gồm một loại nguyên tử duy nhất, được xác định bởi số proton trong hạt nhân, gọi là số hiệu nguyên tử (ký hiệu Z). Nguyên tử khối là tổng số proton và neutron trong hạt nhân. Các nguyên tử của cùng một nguyên tố có số hiệu nguyên tử giống nhau nhưng có thể có số nguyên tử khối khác nhau, gọi là đồng vị. Ví dụ, tất cả các nguyên tử có 6 proton là nguyên tử của nguyên tố carbon, nhưng chúng có thể có nguyên tử khối là 12 hoặc 13.
Các nguyên tố hóa học thường được trình bày theo bảng tuần hoàn, sắp xếp theo số hiệu nguyên tử. Bảng tuần hoàn chia các nguyên tố thành các nhóm (cột) và chu kỳ (hàng), giúp xác định các xu hướng tuần hoàn của chúng.
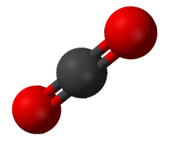
Đơn chất
Hợp chất là chất hóa học tinh khiết được cấu tạo từ nhiều nguyên tố khác nhau. Tính chất của hợp chất thường không giống như các nguyên tố cấu thành nó. Danh pháp của hợp chất được quy định bởi Liên minh Quốc tế về Hóa học thuần túy và Hóa học ứng dụng (IUPAC). Hợp chất hữu cơ có danh pháp theo hệ thống hữu cơ, trong khi hợp chất vô cơ theo hệ thống vô cơ. Các hợp chất có thể được phân chia thành các phần tích điện dương và âm. Dịch vụ Tóm tắt Hóa chất (CAS) cung cấp một số đăng ký CAS để nhận diện các chất hóa học.
Phân tử
Phân tử là phần tử nhỏ nhất của một chất hóa học tinh khiết có tính chất hóa học đặc trưng và có khả năng tham gia vào các phản ứng hóa học với các chất khác. Tuy nhiên, định nghĩa này không áp dụng cho tất cả các chất, đặc biệt là những chất không cấu thành từ phân tử. Các phân tử thường bao gồm các nguyên tử liên kết với nhau qua các liên kết cộng hóa trị, tạo thành cấu trúc trung hòa về điện tích với các điện tử hóa trị liên kết hoặc tạo thành cặp đơn (không nằm trong liên kết).
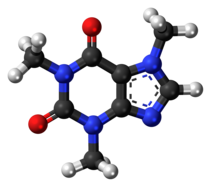
Như đã đề cập, phân tử tồn tại dưới dạng trung hòa điện, khác với các ion. Khi phân tử mang điện tích, nó được gọi là ion phân tử hoặc ion đa nguyên tử. Các ion này thường chỉ tồn tại dưới dạng tách biệt, như trong một chùm chân không tại phổ kế khối. Nhiều ion đa nguyên tử, như ion sunfat hoặc nitrat, có mặt trong đất nhưng thường không được xem là phân tử trong hóa học. Một số phân tử có chứa electron không ghép cặp, tạo ra các gốc tự do. Mặc dù hầu hết các gốc tự do khá phản ứng, một số như nitric oxit (NO) có thể ổn định.
Các nguyên tố khí hiếm hoặc khí trơ như heli, neon, argon, krypton, xenon và radon tồn tại dưới dạng nguyên tử đơn lẻ. Trong khi đó, các chất hóa học khác thường tồn tại dưới dạng phân tử hoặc mạng lưới nguyên tử liên kết với nhau. Những phân tử này có thể là những chất quen thuộc như nước (H2O), không khí (O2), cũng như các hợp chất hữu cơ như rượu (C2H6O hoặc C2H5OH), đường (C12H22O11), muối ăn (NaCl), xăng và nhiều loại dược phẩm khác.
Tuy nhiên, không phải tất cả các chất hay hợp chất hóa học đều bao gồm các phân tử tách biệt. Thực tế, hầu hết các chất rắn cấu thành lớp vỏ và lõi của Trái Đất không tồn tại dưới dạng các phân tử. Các chất như hợp chất ion và chất rắn dạng mạng không có phân tử riêng lẻ mà thay vào đó, chúng được nghiên cứu dưới dạng đơn vị công thức hoặc đơn vị tế bào – cấu trúc lặp lại nhỏ nhất của chất. Ví dụ về các chất này bao gồm muối (như muối ăn), chất rắn như carbon và kim cương, kim loại, silica, và các khoáng chất silicat quen thuộc như thạch anh và granit.
Một đặc điểm quan trọng của phân tử là cấu hình của nó, thường được gọi là cấu trúc hóa học. Trong khi cấu trúc của các phân tử đơn giản gồm hai, ba hoặc bốn nguyên tử có thể dự đoán được (như dạng thẳng, hình chóp góc...), thì cấu trúc của các phân tử đa nguyên tử,


.jpg/100px-Diamants_maclés_2(République_d'Afrique_du_Sud).jpg)



| Ví dụ về các chất tinh khiết. Từ trái qua phải: các nguyên tố Thiếc (Sn) và Lưu huỳnh (S), Kim cương (một dạng thù hình của Carbon), Sucrose (đường ăn), và Natri chloride (muối ăn) và Natri bicarbonat (bột nở), cả hai đều là hợp chất ion. |
có từ hơn 6 nguyên tử (từ nhiều nguyên tố khác nhau), có thể rất quan trọng cho tính chất hóa học của chúng.
Chất và hỗn hợp
Chất hóa học là một dạng vật chất có thành phần và thuộc tính cụ thể. Khi nhiều chất kết hợp lại, chúng tạo thành một hỗn hợp. Ví dụ về hỗn hợp bao gồm không khí và các hợp kim.
Mol và lượng chất
Mol là đơn vị đo lường dùng để biểu thị lượng chất (hay còn gọi là lượng hóa học). Một mol được định nghĩa là số nguyên tử có trong 0,012 kg (12 gram) carbon-12, với nguyên tử carbon-12 ở trạng thái nghỉ và không liên kết. Số lượng các thực thể trong một mol được gọi là hằng số Avogadro, được xác định thực nghiệm là khoảng 6,022 × 1023 thực thể. Nồng độ mol là số lượng chất trong một thể tích dung dịch, và thường được biểu thị dưới dạng mol/dm3.
Thể hoặc trạng thái

Các chất hóa học, ngoài việc có những tính chất đặc trưng riêng biệt, còn có thể tồn tại ở nhiều thể hoặc trạng thái khác nhau. Mặc dù việc phân loại hóa chất chủ yếu dựa trên các đặc tính hóa học, nhưng một số thể đặc biệt có thể ảnh hưởng đến tính chất hóa học. Thể là một tập hợp các trạng thái của hệ thống hóa học có cấu trúc tương tự nhau, thay đổi theo các điều kiện như áp suất và nhiệt độ.

Các tính chất vật lý như mật độ và độ chiết quang thường đặc trưng cho thể của vật chất. Thể của vật chất được xác định qua quá trình chuyển thể, khi năng lượng được đưa vào hoặc rút ra khỏi hệ thống, thay đổi cấu trúc của hệ thống mà không làm thay đổi các điều kiện môi trường.
Sự khác biệt giữa các thể có thể không rõ ràng và liên tục; trong trường hợp này, vật chất được xem như ở trạng thái siêu tới hạn. Khi ba thể cùng tồn tại dưới những điều kiện nhất định, chúng tạo ra điểm ba trạng thái; điểm này ổn định và giúp xác định điều kiện cụ thể cho từng thể.
Các thể phổ biến nhất là rắn, lỏng và khí. Nhiều chất có nhiều thể rắn khác nhau. Ví dụ, sắt có ba thể rắn (alpha, gamma, và delta) thay đổi theo nhiệt độ và áp suất. Sự khác biệt chính giữa các thể rắn là cấu trúc tinh thể, hay cách sắp xếp các nguyên tử. Một thể khác thường gặp trong hóa học là thể lỏng, tức là trạng thái của các chất hòa tan trong dung môi, thường là nước.
Các thể ít phổ biến hơn bao gồm plasma, ngưng tụ Bose-Einstein và ngưng tụ fermion, cùng với các trạng thái từ tính và sắt từ của vật liệu. Mặc dù hầu hết các thể này thường gặp trong các hệ thống ba chiều, nhưng cũng có thể định nghĩa các thể tương tự trong các hệ thống hai chiều, điều này đã thu hút sự chú ý trong nghiên cứu sinh học.
Liên kết
Khi các nguyên tử kết hợp thành phân tử hoặc tinh thể, chúng tạo thành các liên kết hóa học. Một liên kết hóa học có thể được hình dung như là sự cân bằng giữa các điện tích dương trong hạt nhân và các điện tích âm xung quanh. Không chỉ đơn thuần là sự hút và đẩy, mà năng lượng và phân bố của các điện tử cũng đặc trưng cho khả năng tạo liên kết với nguyên tử khác.
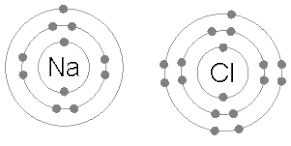
Các liên kết hóa học có thể là liên kết cộng hóa trị, liên kết ion, liên kết hydro hoặc chỉ là lực Van der Waals. Mỗi loại liên kết này có một số đặc tính riêng. Những đặc tính này tạo ra các tương tác giữ các nguyên tử cùng nhau trong phân tử hoặc tinh thể. Trong nhiều hợp chất đơn giản, lý thuyết hóa trị, mô hình VSEPR, và khái niệm số oxy hóa có thể được sử dụng để giải thích cấu trúc phân tử và thành phần của chúng.
Liên kết ion hình thành khi một kim loại mất một hoặc nhiều electron và trở thành cation tích điện dương, trong khi các electron đó được nhận bởi nguyên tử phi kim, tạo thành anion tích điện âm. Hai ion có điện tích trái dấu sẽ hút nhau, và liên kết ion là lực hấp dẫn giữa chúng. Ví dụ, natri (Na) mất một electron để trở thành Na+, trong khi clo (Cl) nhận electron đó để trở thành Cl−. Các ion giữ nhau nhờ lực hút tĩnh điện, tạo thành hợp chất natri chloride (NaCl), hay muối ăn.
Trong liên kết cộng hóa trị, hai nguyên tử chia sẻ một hoặc nhiều cặp electron hóa trị, tạo thành một phân tử trung hòa về điện. Các nguyên tử chia sẻ electron để đạt được cấu hình electron của khí hiếm (với tám electron trong lớp vỏ ngoài cùng) cho mỗi nguyên tử. Các nguyên tử thường kết hợp sao cho mỗi nguyên tử có tám electron trong lớp ngoài cùng, tuân theo quy tắc bát tử (xem Liên kết ion). Tuy nhiên, các nguyên tố như hydro và lithi chỉ cần hai electron trong lớp ngoài cùng để đạt cấu hình ổn định, và tuân theo quy tắc song tử (duet), đạt cấu hình điện tử của helium, một khí hiếm chỉ có hai electron trong lớp ngoài cùng.
Các lý thuyết từ vật lý cổ điển có thể dự đoán cấu trúc của nhiều ion. Đối với các hợp chất phức tạp hơn, như phức hợp kim loại, lý thuyết hóa trị có thể không còn đủ hiệu quả. Thay vào đó, lý thuyết quỹ đạo phân tử (orbital) thường được áp dụng. Xem sơ đồ về quỹ đạo điện tử để biết thêm chi tiết.
Năng lượng
Trong hóa học, năng lượng là thuộc tính của một chất, phản ánh cấu trúc nguyên tử, phân tử hoặc cấu trúc tổng hợp của nó. Khi xảy ra một phản ứng hóa học, sẽ có sự thay đổi trong cấu trúc này, dẫn đến sự thay đổi năng lượng của các chất liên quan. Năng lượng có thể được chuyển giao giữa các chất phản ứng và môi trường dưới dạng nhiệt hoặc ánh sáng, do đó sản phẩm của phản ứng có thể có nhiều hoặc ít năng lượng hơn so với các chất phản ứng ban đầu.
Một phản ứng được coi là giải phóng năng lượng khi trạng thái cuối cùng có năng lượng thấp hơn so với trạng thái ban đầu; ngược lại, phản ứng thu năng lượng sẽ có trạng thái cuối cùng có năng lượng cao hơn. Phản ứng được gọi là tỏa nhiệt nếu nó phát ra nhiệt ra môi trường xung quanh, trong khi phản ứng thu nhiệt thì hấp thụ nhiệt từ môi trường.
Để một phản ứng hóa học xảy ra, các chất phản ứng phải vượt qua một rào cản năng lượng gọi là năng lượng hoạt hóa. Tốc độ của phản ứng hóa học (tại nhiệt độ T) phụ thuộc vào năng lượng hoạt hóa E, theo phân bố Boltzmann - tức là xác suất một phân tử có năng lượng bằng hoặc lớn hơn E ở nhiệt độ T. Phụ thuộc lũy thừa của tần suất phản ứng vào nhiệt độ được gọi là phương trình Arrhenius. Năng lượng kích hoạt cho một phản ứng hóa học có thể ở dạng nhiệt, ánh sáng, điện hoặc lực cơ học như siêu âm.
Khái niệm năng lượng tự do, kết hợp với entropy, là công cụ hữu ích để dự đoán tính khả thi của phản ứng và xác định trạng thái cân bằng trong nhiệt động học hóa học. Một phản ứng chỉ khả thi nếu sự thay đổi tổng năng lượng tự do Gibbs là âm, , nếu giá trị này bằng không, phản ứng được coi là ở trạng thái cân bằng.
Điện tử, nguyên tử và phân tử đều có các trạng thái năng lượng cụ thể, được quy định bởi các nguyên tắc của cơ học lượng tử. Những nguyên tắc này yêu cầu năng lượng của hệ thống phải được lượng tử hóa. Các nguyên tử hoặc phân tử ở trạng thái năng lượng cao hơn gọi là bị kích thích, thường có khả năng phản ứng hóa học cao hơn do năng lượng kích thích của chúng.
Trạng thái của một chất phụ thuộc vào năng lượng của chính nó và năng lượng của môi trường xung quanh. Nếu lực giữa các phân tử trong chất lớn hơn năng lượng từ môi trường, chất sẽ ở dạng lỏng hoặc rắn, như nước (H2O) với liên kết hydro của nó. Ngược lại, hydrogen sulfide (H2S) là khí ở nhiệt độ phòng và áp suất tiêu chuẩn vì liên kết giữa các phân tử của nó yếu hơn do tương tác lưỡng cực-lưỡng cực.
Quá trình chuyển giao năng lượng giữa các chất hóa học phụ thuộc vào năng lượng phát ra từ chất. Năng lượng nhiệt thường được truyền dễ dàng giữa các chất vì phonon, chịu trách nhiệm cho dao động và chuyển động năng lượng trong chất, có năng lượng thấp hơn so với photon truyền năng lượng điện tử. Do đó, năng lượng dao động và chuyển động gần nhau hơn, khiến nhiệt dễ dàng chuyển giao hơn so với ánh sáng hoặc năng lượng điện tử. Ví dụ, bức xạ tia cực tím không truyền hiệu quả như năng lượng nhiệt hay điện.
Các mức năng lượng đặc trưng cho các chất hóa học khác nhau rất quan trọng trong việc phân tích quang phổ. Các phương pháp quang phổ khác nhau như NIRS, vi sóng, NMR, và EPR (cộng hưởng thuận từ electron) thường được sử dụng. Quang phổ cũng giúp xác định thành phần của các ngôi sao xa và thiên hà bằng cách phân tích phổ xạ của chúng.
Năng lượng hóa học thường được hiểu là khả năng của một chất hóa học để thực hiện phản ứng hoặc thay đổi thành phần hóa học của các chất khác thông qua một quá trình hóa học.
Phản ứng hóa học

Khi một chất hóa học tương tác với một chất khác hoặc với năng lượng, phản ứng hóa học xảy ra. Khái niệm này liên quan đến việc một chất phản ứng khi tiếp xúc với chất khác, hỗn hợp, dung dịch, hay một dạng năng lượng. Phản ứng hóa học thường tạo ra sự trao đổi năng lượng giữa các phản ứng và môi trường, có thể là trong các thiết bị thí nghiệm đặc biệt như bình thủy tinh.
Phản ứng hóa học có thể dẫn đến việc hình thành hoặc phân hủy các phân tử - tức là các phân tử có thể bị chia nhỏ thành nhiều phần hơn hoặc tái sắp xếp lại nguyên tử. Các phản ứng thường thấy bao gồm phản ứng oxy hóa-khử, phản ứng phân tách, trung hòa acid-base và tái sắp xếp nguyên tử.
Phản ứng hóa học có thể được biểu diễn qua các phương trình hóa học. Đối với phản ứng không liên quan đến hạt nhân, số lượng và loại nguyên tử ở cả hai phía của phương trình phải bằng nhau. Ngược lại, trong phản ứng hạt nhân, điều này chỉ áp dụng cho các hạt trong hạt nhân như proton và neutron.
Quá trình mà các liên kết hóa học được thay đổi trong phản ứng hóa học được gọi là cơ chế phản ứng. Phản ứng có thể diễn ra qua nhiều bước, với mỗi bước có thể có tốc độ khác nhau. Một số phản ứng trung gian có thể xuất hiện và các cơ chế phản ứng được đề xuất để giải thích động học và tỷ lệ sản phẩm của phản ứng. Các nhà hóa lý thường nghiên cứu và đề xuất các cơ chế phản ứng khác nhau. Quy tắc thực nghiệm như quy tắc Woodward-Hoffmann thường hữu ích khi đưa ra cơ chế cho phản ứng hóa học.
Theo định nghĩa của IUPAC, phản ứng hóa học là 'quá trình chuyển hóa lẫn nhau giữa các loại chất hóa học'. Do đó, phản ứng hóa học có thể đơn giản hoặc xảy ra qua nhiều bước.
Ion và muối

Ion là các phần tử mang điện, có thể là nguyên tử hoặc phân tử, đã mất hoặc thu nhận một hoặc nhiều electron. Khi một nguyên tử mất electron và có nhiều proton hơn electron, nó trở thành ion dương hay cation. Ngược lại, khi một nguyên tử nhận thêm electron và có nhiều electron hơn proton, nó trở thành ion âm hay anion. Các ion dương và âm có thể kết hợp để tạo thành các mạng tinh thể của muối trung hòa, như ion Na và Cl tạo thành NaCl. Ví dụ về các ion đa nguyên tử không phân rã trong phản ứng acid-base là ion hydroxide (OH) và phosphate (PO4).
Plasma là trạng thái của khí khi đã bị ion hóa hoàn toàn, thường xảy ra ở nhiệt độ rất cao.
Tính axit và bazơ
Một chất có thể được phân loại là acid hoặc bazơ. Các lý thuyết về axit có nhiều biến thể, trong đó thuyết Arrhenius cho rằng một acid là chất tạo ra ion , còn bazơ tạo ra ion khi hòa tan trong nước. Theo lý thuyết acid-base của Bronsted-Lowry, acid là chất cung cấp ion trong một phản ứng hóa học, trong khi bazơ là chất nhận ion trong phản ứng.
Lý thuyết phổ biến thứ ba là lý thuyết Lewis, tập trung vào sự hình thành các liên kết hóa học mới. Theo lý thuyết của Lewis, acid là chất có khả năng nhận một cặp electron từ chất khác trong quá trình liên kết, còn base là chất cung cấp một cặp electron để tạo thành liên kết mới. Lý thuyết này nhấn mạnh sự trao đổi điện tích. Có nhiều cách khác để phân loại một chất là acid hay base, phản ánh sự phát triển của khái niệm này qua thời gian.
Sự mạnh của acid thường được đo bằng hai phương pháp chính. Một là đo độ pH, theo định nghĩa của Arrhenius về axit, biểu thị nồng độ ion trong dung dịch qua thang logarit. Phương pháp thứ hai, dựa trên định nghĩa của Bronsted - Lowry, là hằng số phân ly acid, đo lường khả năng hoạt động của acid. Chất có giá trị Ka cao hơn có xu hướng giải phóng nhiều ion hơn là những chất có giá trị Ka thấp.
Oxy hóa-khử
Phản ứng oxy hóa-khử bao gồm tất cả các phản ứng hóa học trong đó các nguyên tử thay đổi trạng thái oxy hóa bằng cách nhận thêm electron (quá trình khử) hoặc mất electron (quá trình oxy hóa). Các chất có khả năng oxy hóa các chất khác được gọi là chất oxy hóa, và chúng loại bỏ electron từ chất khác. Tương tự, các chất có khả năng khử các chất khác gọi là chất khử.
Một chất khử truyền electron cho một chất khác và do đó bị oxy hóa. Vì nó 'tặng' electron, nó cũng được gọi là chất cho electron. Các thuật ngữ 'oxy hóa' và 'khử' có thể không phản ánh đúng sự chuyển giao electron thực tế. Thay vào đó, quá trình oxy hóa thường được định nghĩa là sự gia tăng số oxy hóa, trong khi khử là sự giảm số oxy hóa.
Cân bằng
Khái niệm cân bằng được áp dụng rộng rãi trong khoa học, đặc biệt trong hóa học, khi có nhiều trạng thái khác nhau của một hợp chất hóa học có thể tồn tại đồng thời. Ví dụ, một hỗn hợp của nhiều hợp chất có thể tương tác với nhau, hoặc một chất có thể xuất hiện trong nhiều trạng thái khác nhau.
Khi một hệ thống hóa học đạt trạng thái cân bằng, mặc dù thành phần có thể không thay đổi, nhưng hệ thống không hoàn toàn tĩnh; các phân tử vẫn tiếp tục phản ứng, dẫn đến trạng thái cân bằng động. Điều này nghĩa là các yếu tố như thành phần hóa học vẫn ổn định theo thời gian.
Tầm quan trọng
Đời sống
Các phản ứng hóa học diễn ra trong cuộc sống hàng ngày, chẳng hạn như khi nấu ăn, làm bánh hoặc rán, trong đó các biến đổi chất phức tạp tạo nên hương vị đặc trưng của món ăn. Đồng thời, thức ăn được phân tách thành các thành phần riêng biệt và chuyển hóa thành năng lượng.
Liên hệ với khoa học khác
Hóa học nghiên cứu các đặc tính của nguyên tố và hợp chất, các quá trình biến đổi từ chất này sang chất khác, dự đoán tính chất của hợp chất chưa được biết đến, cung cấp phương pháp tổng hợp hợp chất mới và các kỹ thuật phân tích để xác định thành phần hóa học trong mẫu thử.
Dù tất cả các chất đều được cấu tạo từ một số nguyên tố cơ bản (khoảng 80 đến 100 trong tổng số 118 nguyên tố đã biết), sự kết hợp và sắp xếp khác nhau của các nguyên tố đã tạo ra hàng triệu hợp chất khác nhau, từ nước, cát đến mô sinh vật và thực vật. Chính sự kết hợp của các nguyên tố quyết định các tính chất vật lý và hóa học của các chất, làm cho hóa học trở thành một lĩnh vực khoa học phong phú.
Giống như các ngành khoa học tự nhiên khác, thí nghiệm là nền tảng của hóa học. Thông qua thí nghiệm, các lý thuyết về sự biến đổi chất được phát triển, kiểm chứng, mở rộng và điều chỉnh khi cần thiết.
Những bước tiến trong các lĩnh vực khác nhau của hóa học thường là điều kiện tiên quyết cho những khám phá mới trong các ngành khoa học khác, đặc biệt là sinh học và y học, cũng như vật lý (ví dụ như việc phát triển các chất siêu dẫn mới). Hóa sinh, một lĩnh vực quan trọng nằm giữa hóa học và sinh học, đóng vai trò thiết yếu trong việc hiểu các quá trình sinh học, liên quan chặt chẽ đến sự biến đổi chất.
Trong y học, hóa học là chìa khóa để tìm ra thuốc mới và sản xuất dược phẩm. Các kỹ sư tìm kiếm vật liệu đặc biệt cho các ứng dụng cụ thể (như vật liệu nhẹ cho máy bay, vật liệu xây dựng chịu lực, chất bán dẫn tinh khiết,...) và khoa học vật liệu đã trở thành cầu nối giữa hóa học và kỹ thuật.
Trong công nghiệp
Ngành công nghiệp hóa học đóng vai trò thiết yếu trong nền kinh tế. Nó sản xuất các hóa chất cơ bản như axit sulfuric và amonia, với số lượng lên tới hàng triệu tấn mỗi năm, phục vụ cho sản xuất phân bón, chất dẻo và các lĩnh vực khác của đời sống và công nghiệp. Đồng thời, ngành công nghiệp hóa học cũng sản xuất nhiều hợp chất phức tạp, đặc biệt là dược phẩm. Không có các hóa chất công nghiệp, việc sản xuất máy tính, nhiên liệu và chất bôi trơn cho ngành ô tô sẽ không thể thực hiện được.
Phân ngành
Hóa học được chia thành nhiều lĩnh vực chính, bên cạnh đó còn có nhiều lĩnh vực liên ngành và chuyên ngành khác.
- Hóa phân tích tập trung vào việc phân tích các mẫu để hiểu rõ về thành phần và cấu trúc hóa học của chúng. Phương pháp hóa phân tích kết hợp các kỹ thuật thực nghiệm chuẩn mực trong hóa học và có thể áp dụng cho mọi lĩnh vực trong hóa học, trừ lý thuyết thuần túy.
- Hóa sinh nghiên cứu các phản ứng hóa học và tương tác hóa học xảy ra trong sinh vật sống. Nó có sự liên quan chặt chẽ với hóa học hữu cơ, đặc biệt là trong hóa dược, và kết nối với sinh học phân tử và di truyền học.
- Hóa học vô cơ nghiên cứu các tính chất và phản ứng của các hợp chất vô cơ. Mặc dù có sự phân biệt giữa hóa học hữu cơ và vô cơ, nhưng có sự trùng lặp nhiều trong các lĩnh vực như hóa học cơ kim.
- Hóa học vật liệu nghiên cứu, mô tả và phát triển các chất với chức năng đặc biệt. Đây là một lĩnh vực nghiên cứu mới kết hợp yếu tố từ các lĩnh vực hóa học cổ điển, tập trung vào các vấn đề cơ bản độc đáo cho vật liệu, bao gồm hóa học các pha và các pha chuyển giao.
- Hóa học thần kinh nghiên cứu các chất hóa học thần kinh như chất dẫn truyền, peptide, protein, lipid, đường và axit nucleic; và vai trò của chúng trong việc hình thành, duy trì và sửa đổi hệ thần kinh.
- Hóa học hạt nhân nghiên cứu cách các hạt hạ nguyên tử kết hợp để tạo thành hạt nhân. Chuyển đổi hạt nhân là một phần quan trọng của hóa học hạt nhân và bảng tuần hoàn các nguyên tố hóa học là công cụ thiết yếu cho lĩnh vực này.
- Hóa học hữu cơ nghiên cứu cấu trúc, tính chất, thành phần, cơ chế và phản ứng của các hợp chất hữu cơ, chủ yếu là các hợp chất có nền tảng mạch carbon.
- Hóa học vật lý nghiên cứu cơ sở vật chất và cơ bản của các hệ thống và quá trình hóa học, bao gồm nhiệt động học, động học, điện hóa học, cơ học thống kê, quang phổ, và hóa học vũ trụ. Hóa học vật lý có sự chồng chéo lớn với vật lý phân tử và thường liên quan đến hóa học lượng tử và lý thuyết hóa học.
- Hóa học lý thuyết nghiên cứu hóa học thông qua lý thuyết cơ bản, đặc biệt là trong toán học hoặc vật lý. Hóa học lượng tử là ứng dụng cơ học lượng tử vào hóa học. Với sự phát triển của máy tính, hóa học tính toán đã trở thành một lĩnh vực quan trọng, phát triển các chương trình máy tính để giải quyết vấn đề hóa học. Hóa học lý thuyết có sự liên kết lớn với vật lý vật chất ngưng tụ và vật lý phân tử.
