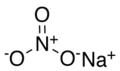
| Natri nitrat | |||
|---|---|---|---|
|
| |||
| Danh pháp IUPAC | Natri nitrat | ||
| Tên khác | Caliche Diêm tiêu Chile Nitrat soda Nitratine Diêm tiêu Peru Soda niter cubic niter | ||
| Nhận dạng | |||
| Số CAS | 7631-99-4 | ||
| PubChem | 24268 | ||
| Số RTECS | WC5600000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ | ||
| InChI | đầy đủ | ||
| UNII | 8M4L3H2ZVZ | ||
| Thuộc tính | |||
| Công thức phân tử | NaNO3 | ||
| Khối lượng mol | 84,9932 g/mol | ||
| Bề ngoài | bột trắng hay tinh thể không màu có vị ngọt | ||
| Khối lượng riêng | 2,257 g/cm³, rắn | ||
| Điểm nóng chảy | 308 °C (581 K; 586 °F) | ||
| Điểm sôi | 380 °C (653 K; 716 °F) (phân huỷ) | ||
| Độ hòa tan trong nước | 730 g/L (0°C) 921 g/L (25°C) 1800 g/L (100°C) | ||
| Độ hòa tan | tan rất tốt trong amonia; tan được trong cồn | ||
| Chiết suất (nD) | 1,587 (dạng tam giác) 1,336 (trực thoi) | ||
| Cấu trúc | |||
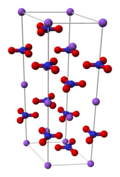
| Cấu trúc tinh thể | tam giác và trực thoi | ||
| Nhiệt hóa học | |||
| Enthalpy hình thành ΔfH298 | −468 kJ/mol | ||
| Entropy mol tiêu chuẩn S298 | 117 J·mol K | ||
| Các nguy hiểm | |||
| MSDS | ICSC 0185 | ||
| Chỉ mục EU | không có trong danh sách | ||
| Nguy hiểm chính | chất oxi hoá, gây kích thích | ||
| NFPA 704 |
0
1
0
OX
| ||
| Điểm bắt lửa | không cháy | ||
| LD50 | 3236 mg/kg | ||
| Các hợp chất liên quan | |||
| Anion khác | Natri nitrit | ||
| Cation khác | Lithi nitrat Kali nitrat Rubidi nitrat Caesi nitrat | ||
| Hợp chất liên quan | Natri sunfat Natri chloride | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa).
(cái gì ?)
Tham khảo hộp thông tin | |||
Natri nitrat là hợp chất hóa học có công thức NaNO3. Muối này còn được gọi là diêm tiêu Chile hoặc diêm tiêu Peru (do hai nơi này có lượng trầm tích lớn nhất) để phân biệt với kali nitrat, và là một chất rắn màu trắng tan trong nước. Dạng khoáng vật còn có tên là nitratin, nitratit hay soda niter.
Natri nitrat được sử dụng làm nguyên liệu trong phân bón, pháo hoa, nguyên liệu của bom khói, chất bảo quản, và như một chất đẩy tên lửa, cũng như trong sản xuất thủy tinh và men gốm. Hợp chất này đang được khai thác cho nhiều mục đích trên.
Lịch sử
Những chuyến hàng natri nitrat đầu tiên đến châu Âu cập bến ở Anh vào khoảng những năm 1820-1825, nhưng không tìm được khách hàng nào và bị đổ xuống biển để tránh thuế. Tuy nhiên, theo thời gian, các mỏ muối ở Nam Mỹ đã trở thành nguồn kinh doanh màu mỡ (năm 1859, nước Anh tiêu thụ tổng cộng 47.000 tấn). Chile tiến hành cuộc chiến với liên minh Peru và Bolivia trong cuộc chiến tranh Thái Bình Dương 1879-1884 và chiếm lĩnh nguồn quặng lớn nhất. Năm 1919, Ralph Walter Graystone Wyckoff đã khám phá ra cấu trúc tinh thể của nó nhờ phương pháp tinh thể học tia X.
Nguồn tài nguyên
Nguồn natri nitrat tự nhiên lớn nhất được tìm thấy ở Chile và Peru, nơi các muối nitrat kết rắn lại trong các trầm tích gọi là quặng caliche. Trong hơn một thế kỷ, nguồn cung cấp chính cho thế giới được khai thác từ hoang mạc Atacama ở bắc Chile bằng thuốc nổ cho đến khi, vào thế kỷ 20, hai nhà hóa học người Đức Fritz Haber và Carl Bosch phát triển một quy trình sản xuất amonia từ không khí theo quy trình công nghiệp (xem quy trình Haber). Khi chiến tranh thế giới thứ nhất bùng nổ, Đức bắt đầu biến đổi amonia từ quy trình này sang diêm tiêu Chile nhân tạo, rất hữu ích như nguồn nguyên liệu tự nhiên trong sản xuất thuốc súng và các loại vũ khí khác. Vào thập niên 1940, quá trình này dẫn đến sự giảm mạnh nhu cầu về natri nitrat tự nhiên.
Chile vẫn là nguồn dự trữ caliche lớn nhất, với nhiều mỏ đang hoạt động ở các vùng Pedro de Valdivia, María Elena và Pampa Blanca, và nó thường được gọi là vàng trắng. Natri nitrat, kali nitrat, natri sunfat và iod vẫn được khai thác bằng quy trình caliche. Các cộng đồng khai thác mỏ Humberstone và Santa Laura được tuyên bố là di sản thế giới vào năm 2005.
Natri nitrat được sản xuất trong công nghiệp bằng phản ứng trung hòa axit nitric với natri cacbonat.
Ứng dụng
Natri nitrat được sử dụng rộng rãi như một loại phân bón và nguyên liệu thô trong sản xuất thuốc súng vào cuối thế kỷ 19. Nó cũng có thể kết hợp với sắt hydroxide để tạo ra nhựa thông.
Không nên nhầm lẫn natri nitrat với hợp chất liên quan, natri nitrit.
Nó có thể được dùng để sản xuất axit nitric khi phản ứng với axit sunfuric rồi tách axit nitric ra qua quá trình chưng cất phân đoạn, còn lại là natri hydrosunfat. Những người săn vàng sử dụng natri nitrat để điều chế nước cường toan, có khả năng hòa tan vàng và các kim loại quý khác.
Ứng dụng ít phổ biến hơn của nó là như một chất oxi hóa thay thế trong pháo hoa, thay thế kali nitrat trong thuốc nổ đen, và như một thành phần trong túi lạnh.
Natri nitrat cũng được sử dụng cùng với kali nitrat để bảo quản nhiệt và gần đây, trong việc chuyển đổi nhiệt ở các tháp năng lượng mặt trời.
Ngoài ra, natri nitrat còn được sử dụng trong công nghiệp xử lý nước thải để hỗ trợ quá trình hô hấp tùy ý của vi sinh vật. Vi khuẩn Nitrosomonas hấp thụ nitrat thay vì oxy, giúp chúng phát triển tốt trong nước thải cần xử lý.
Mối quan tâm về sức khoẻ
Giống như natri nitrit, natri nitrat có thể tạo ra nitrosamin, một chất gây ung thư ở người, gây tổn hại DNA và tăng thoái hóa tế bào. Nghiên cứu cho thấy mối liên hệ giữa hàm lượng nitrat và nguy cơ tử vong do Alzheimer, tiểu đường, và Parkinson, có thể thông qua tác động của nitrosamin lên DNA. Nitrosamin, hình thành từ thịt được xử lý bằng natri nitrat và nitrit, liên quan đến ung thư dạ dày và thực quản. Natri nitrat và nitrit cũng liên quan đến nguy cơ cao mắc ung thư đại trực tràng. Quỹ Nghiên cứu Ung thư Vương quốc Anh cho biết một trong những nguyên nhân thịt chế biến làm tăng nguy cơ ung thư ruột kết là do hàm lượng nitrat. Một lượng nhỏ nitrat trong thịt như chất bảo quản bị phân hủy thành nitrit, cùng với nitrit có sẵn trong thịt. Nitrit này phản ứng với thực phẩm giàu protein (như thịt) tạo ra các hợp chất N-nitroso. Một số hợp chất này đã được biết là có khả năng gây ung thư. N-nitroso không chỉ hình thành khi thịt được xử lý mà còn trong quá trình tiêu hóa thịt.
- Chiến tranh Thái Bình Dương (hay chiến tranh diêm tiêu)
Đọc thêm
- Barnum, Dennis (2003). “Lịch sử của Nitrates”. Journal of Chemical Education. 80: 1393–. doi:10.1021/ed080p1393.
Liên kết ngoài
- ATSDR — Nghiên cứu Y học Môi trường - Độc tính của Nitrate/Nitrite U.S. Department of Health and Human Services (phạm vi công cộng)
- Báo cáo FAO/WHO
Hợp chất natri | |
|---|---|
| Hợp chất vô cơ |
|
| Hợp chất hữu cơ |
|
| HNO3 | He | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO 3) 4 |
C | NO 3, NH4NO3 |
O | FNO3 | Ne | ||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClNO3 | Ar | ||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4, TiO(NO3)2 |
V(NO3)2, V(NO3)3, VO(NO3)2, VO(NO3)3, VO2NO3 |
Cr(NO3)2, Cr(NO3)3, CrO2(NO3)2 |
Mn(NO3)2, Mn(NO3)3 |
Fe(NO3)2, Fe(NO3)3 |
Co(NO3)2, Co(NO3)3 |
Ni(NO3)2 | CuNO3, Cu(NO3)2 |
Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | BrNO3 | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4, ZrO(NO3)2 |
Nb | Mo(NO3)2, Mo(NO3)3, Mo(NO3)4, Mo(NO3)6 |
Tc | Ru(NO3)3 | Rh(NO3)3 | Pd(NO3)2, Pd(NO3)4 |
AgNO3, Ag(NO3)2 |
Cd(NO3)2 | In(NO3)3 | Sn(NO3)2, Sn(NO3)4 |
Sb(NO3)3 | Te | INO3 | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf(NO3)4, HfO(NO3)2 |
Ta | W(NO3)6 | ReO3NO3 | Os(NO3)2 | Ir3O(NO3)10 | Pt(NO3)2, Pt(NO3)4 |
HAu(NO3)4 | Hg2(NO3)2, Hg(NO3)2 |
TlNO3, Tl(NO3)3 |
Pb(NO3)2 | Bi(NO3)3, BiO(NO3) |
Po(NO3)2, Po(NO3)4 |
At | Rn | |
| FrNO3 | Ra(NO3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3, Ce(NO3)4 |
Pr(NO3)3 | Nd(NO3)3 | Pm(NO3)2, Pm(NO3)3 |
Sm(NO3)3 | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy(NO3)3 | Ho(NO3)3 | Er(NO3)3 | Tm(NO3)3 | Yb(NO3)3 | Lu(NO3)3 | |||
| Ac(NO3)3 | Th(NO3)4 | PaO(NO3)3 | U(NO3)4, UO2(NO3)2 |
Np(NO3)4 | Pu(NO3)4, PuO2(NO3)2 |
Am(NO3)3 | Cm(NO3)3 | Bk(NO3)3 | Cf(NO3)3 | Es | Fm | Md | No | Lr | |||
