
| Natri sunfat | |||
|---|---|---|---|
|
| |||
| Tên khác | Thenardite (khoáng vật) muối Glauber (decahydrat) Sal mirabilis (decahydat) Mirabilite (decahydrat) | ||
| Nhận dạng | |||
| Số CAS | 7757-82-6 | ||
| PubChem | 24436 | ||
| ChEBI | 32149 | ||
| ChEMBL | 233406 | ||
| Số RTECS | WE1650000 | ||
| Mã ATC | A06AD13,A12CA02 (WHO) | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ | ||
| InChI | đầy đủ | ||
| UNII | 36KCS0R750 | ||
| Thuộc tính | |||
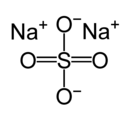
| Công thức phân tử | Na2SO4 | ||
| Khối lượng mol | 142.04 g/mol (khan) 322.20 g/mol (decahydrat) | ||
| Bề ngoài | tinh thể rắn màu trắng hút ẩm | ||
| Mùi | không mùi | ||
| Khối lượng riêng | 2.664 g/cm³ (khan) 1.464 g/cm³ (decahydrat) | ||
| Điểm nóng chảy | 884 °C (khan) 32.38 °C (decahydrat) | ||
| Điểm sôi | 1429 °C (khan) | ||
| Độ hòa tan trong nước | khan: 4.76 g/100 mL (0 °C) 42.7 g/100 mL (100 °C) heptahiđrat: 19.5 g/100 mL (0 °C) 44 g/100 mL (20 °C) | ||
| Độ hòa tan | không tan trong ethanol tan trong glyxerol và hydro iodide | ||
| Chiết suất (nD) | 1.468 (khan) 1.394 (decahydrat) | ||
| Cấu trúc | |||
| Cấu trúc tinh thể | trực thoi hay lục phương (khan) đơn tà (decahydrat) | ||
| Các nguy hiểm | |||
| MSDS | ICSC 0952 | ||
| Chỉ mục EU | không được liệt kê | ||
| Nguy hiểm chính | gây kích ứng | ||
| NFPA 704 |
0
1
0
| ||
| Điểm bắt lửa | không cháy | ||
| Các hợp chất liên quan | |||
| Anion khác | Natri selenat Natri tellurat | ||
| Cation khác | Lithi sunfat Kali sulfat Rubidi sunfat Caesi sunfat | ||
| Hợp chất liên quan | Natri bisunfat Natri sunfit Natri persunfat | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa).
(cái gì ?)
Tham khảo hộp thông tin | |||
Natri sulfat là muối natri của axit sulfuric. Ở dạng khô, đó là một tinh thể rắn màu trắng với công thức Na2SO4 được biết đến như là khoáng vật thenardite; Na2SO4·10H2O tồn tại tự nhiên dưới dạng khoáng vật mirabilite và trong công nghiệp sản xuất, nó còn được gọi là muối Glauber hay mang tính lịch sử hơn là sal mirabilis từ thế kỷ 17. Một dạng khác là tinh thể heptahiđrat được tách từ mirabilite khi làm lạnh. Với sản lượng sản xuất hàng năm lên đến 6 triệu tấn, đây là một sản phẩm hóa chất toàn cầu quan trọng.
Natri sulfat được ứng dụng chủ yếu trong sản xuất thuốc tẩy và trong phương pháp Kraft để làm bột giấy. Khoảng 2/3 lượng natri sulfat toàn cầu là từ mirabilite, dạng khoáng vật tự nhiên của muối đecahiđrat, và phần còn lại là từ phụ phẩm của các ngành công nghiệp hóa chất khác như sản xuất axit clohydric.
Lịch sử
Muối natri sulfat ngậm nước được biết dưới tên muối Glauber sau khi nhà hóa học và dược sĩ người Đức/Hà Lan Johann Rudolf Glauber (1604–1670) phát hiện nó vào năm 1625 trong nước của một suối tại Áo. Ông đặt tên nó là sal mirabilis (muối kỳ lạ), vì những đặc tính y học của loại muối này: những tinh thể muối đã được dùng để làm thuốc nhuận tràng cho đến khi có những chất thay thế phức tạp hơn ra đời vào những năm 1900.
Vào thế kỷ 18, muối Glauber bắt đầu được sử dụng làm nguyên liệu thô cho quá trình sản xuất soda trong công nghiệp, khi phản ứng với kali cacbonat. Nhu cầu tăng cao đã đẩy nguồn cung natri sulfat lên một mức đáng kể. Do đó, vào thế kỷ 19, quy mô sản xuất natri sulfat tổng hợp bằng phương pháp Leblanc trở thành chủ đạo trong sản xuất soda.
Đặc tính hóa học và vật lý
Natri sulfat rất ổn định về mặt hóa học, không phản ứng với hầu hết các chất oxy hóa khử ở điều kiện thông thường. Ở nhiệt độ cao, nó có thể bị khử thành natri sulfua bởi cacbon:
- Na2SO4 + 2 C → Na2S + 2 CO2
Tính axit-base
Natri sulfat là muối trung hòa, khi hòa tan trong nước tạo thành dung dịch có pH = 7. Tính trung hòa chỉ ra rằng gốc sunfat bắt nguồn từ axit mạnh acid sulfuric. Hơn nữa, ion Na, với chỉ một điện tích dương, có khả năng phân cực các phân tử nước rất yếu miễn là có ion kim loại trong dung dịch. Natri sulfat phản ứng với acid sulfuric tạo thành muối axit natri bisunfat:
- Na2SO4 + H2SO4 ⇌ 2 NaHSO4
Hằng số cân bằng của quá trình này phụ thuộc vào nồng độ và nhiệt độ.
Độ tan và sự trao đổi ion
Natri sulfat có tính tan rất đặc biệt trong nước. Độ tan của nó tăng gấp hơn mười lần trong khoảng từ 0 °C đến 32.384 °C, điểm mà độ tan đạt giá trị cực đại 497 g/L. Tại điểm này, đường biểu diễn độ tan có dạng uốn cong hướng xuống, và độ tan không còn phụ thuộc vào nhiệt độ. Nhiệt độ 32.384 °C, tương ứng với nhiệt độ làm giải phóng nước ra khỏi tinh thể và tan chảy muối ngậm nước, cung cấp giá trị nhiệt độ tham khảo chính xác cho việc chuẩn đoán nhiệt kế.
Natri sulfat là một loại muối ion phổ biến, bao gồm các ion Na và SO4. Sự có mặt của sunfat trong dung dịch có thể được nhận biết dễ dàng bằng cách tạo thành các sunfat kết tủa khi xử lý dung dịch này với các muối Ba hoặc Pb:
- Na2SO4 + BaCl2 → 2 NaCl + BaSO4↓ sản phẩm
Natri sulfat cũng có xu hướng tạo thành các muối kép ở mức vừa phải. Các phức chất duy nhất được tạo ra với các kim loại hóa trị ba thông thường bao gồm NaAl(SO4)2 (không bền ở trên 39 °C) và NaCr(SO4)2. Điều này ngược lại với kali sulfat và amoni sunfat, tạo ra nhiều loại phức chất bền hơn. Các muối kép với một số kim loại kiềm khác bao gồm Na2SO4·3K2SO4, một khoáng vật tự nhiên là glaserit. Glaserit được hình thành thông qua phản ứng giữa natri sulfat và kali clorua, được sử dụng như là cơ sở của một phương pháp sản xuất kali sulfat, một loại phân bón. Các muối kép khác bao gồm 3Na2SO4·CaSO4, 3Na2SO4·MgSO4 (vanthoffite) và NaF·Na2SO4.
Cấu trúc tinh thể
Các phân tử có cấu trúc bát diện như [Na(OH2)6] ion được phát hiện trong nhiều loại muối sunfat kim loại. Các ion dương này kết nối với sunfat qua liên kết hydro. Độ dài liên kết Na-O là 240 pm. Mỗi đơn vị công thức không phối trí với Na có hai phân tử nước. Tinh thể natri sunfat đecahiđrat khác biệt với các muối ngậm nước khác vì có entropy dư thừa (entropy ở nhiệt độ không tuyệt đối) là 6.32 J·K·mol, do khả năng phân bố nước nhanh hơn rất nhiều so với hầu hết các muối khác.
Sản phẩm
Sản lượng natri sunfat trên toàn cầu chủ yếu là dạng đecahiđrat, khoảng từ 5.5 đến 6 triệu tấn mỗi năm. Năm 1985, tổng sản lượng là 4.5 triệu tấn/năm, một nửa từ tự nhiên và một nửa từ công nghiệp hóa chất. Từ năm 2000 đến 2006, sản lượng từ nguồn tự nhiên tăng lên 4 triệu tấn/năm, trong khi sản xuất từ công nghiệp giảm xuống từ 1.5 đến 2 triệu tấn/năm, tổng cộng 5.5 đến 6 triệu tấn/năm. Với tất cả các ứng dụng, natri sunfat từ tự nhiên và hóa học có thể thay thế lẫn nhau.
Nguồn nguyên liệu tự nhiên
2/3 sản lượng natri sunfat trên thế giới đến từ khoáng vật thiên nhiên mirabilite, ví dụ như mẫu khoáng vật tìm thấy ở dưới đáy hồ ở phía nam Saskatchewan. Năm 1990, Mexico và Tây Ban Nha là nguồn cung cấp natri sunfat thiên nhiên lớn nhất thế giới (mỗi nước khoảng 500,000 tấn), cùng với Nga, Hoa Kỳ và Canada đóng góp khoảng 350,000 tấn mỗi quốc gia. Nguồn tự nhiên được ước tính vượt quá 1 tỉ tấn.
Các nhà sản xuất lớn sản xuất từ 200,000 đến 1,500,000 tấn/năm vào năm 2006 bao gồm Searles Valley Minerals (California, Mỹ), Airborne Industrial Minerals (Saskatchewan, Canada), Química del Rey (Coahuila, Mexico), Minera de Santa Marta và Criaderos Minerales Y Derivados, còn được biết đến là Grupo Crimidesa (Burgos, Tây Ban Nha), Minera de Santa Marta (Toledo, Tây Ban Nha), Sulquisa (Madrid, Tây Ban Nha), và ở Trung Quốc là Chengdu Sanlian Tianquan Chemical (Tứ Xuyên), Hongze Yinzhu Chemical Group (Giang Tô), Nafine Chemical Industry Group (Sơn Tây), và Sichuan Province Chuanmei Mirabilite (Tứ Xuyên), và Kuchuksulphat JSC (Altai Krai, Siberia, Nga). Tại Saskatchewan, một trong những mỏ chính là Saskatchewan Minerals.
Muối natri sunfat khô cứng có mặt ở những vùng khô cằn dưới dạng khoáng vật thenardite. Nó dần chuyển thành mirabilite khi tiếp xúc với không khí ẩm. Ngoài ra, nó cũng được tìm thấy dưới dạng glauberite, một khoáng vật calci natri sunfat. Cả hai loại khoáng vật này ít phổ biến hơn so với mirabilite.
Công nghiệp hóa chất
Khoảng 1/3 lượng natri sunfat còn lại được sản xuất từ phụ phẩm của các quá trình khác trong ngành công nghiệp hóa chất. Phần lớn chúng là sản phẩm phụ của các quy trình khác, có giá trị kinh tế bên lề. Do đó, lượng natri sunfat sản xuất từ phụ phẩm này đang giảm dần do sự phát triển của ngành công nghiệp.
Phần lớn natri sunfat được thu từ quá trình sản xuất axit clohydric, từ natri chloride (muối ăn) và acid sulfuric, trong quá trình Mannheim, hoặc từ lưu huỳnh dioxide trong quá trình Hargreaves. Natri sunfat thu được từ hai quy trình trên được gọi là bánh muối.
- Mannheim: 2 NaCl + H2SO4 → 2 HCl + Na2SO4
- Hargreaves: 4 NaCl + 2 SO2 + O2 + 2 H2O → 4 HCl + 2 Na2SO4
Nguồn natri sunfat sản xuất lớn thứ hai là từ quá trình trung hòa axit sunfuric bằng natri hydroxide, được sử dụng rộng rãi trong sản xuất sợi tổng hợp. Phương pháp này cũng được áp dụng phổ biến trong phòng thí nghiệm.
- 2 NaOH(aq) + H2SO4(aq) → Na2SO4(aq) + 2 H2O(l)
Trong phòng thí nghiệm, natri sunfat còn được tổng hợp từ phản ứng giữa natri bicacbonat và magie sunfat.
- 2NaHCO3 + MgSO4 → Na2SO4 + Mg(OH)2 + 2CO2
Trước đây, natri sunfat là sản phẩm phụ của quá trình sản xuất natri đicromat, khi axit sunfuric được thêm vào natri cromat để tạo thành natri đicromat hoặc sau đó là axit cromic. Ngoài ra, natri sunfat cũng được tạo ra từ các quá trình sản xuất natri sunfat và hình thành trong sản xuất lithi cacbonat, chất tạo phức, resorcinol, axit ascorbic, chất tạo màu silica, axit nitric và phenol.
Natri sunfat dạng rắn thường được tinh chế từ dạng đecahiđrat, vì dạng khan có khả năng hút các hợp chất hữu cơ và chứa sắt. Dạng rắn được sản xuất dễ dàng từ dạng ngậm nước bằng phương pháp đun nóng nhẹ.
Các nhà sản xuất chính của natri sunfat phụ phẩm vào khoảng 50–80 triệu tấn/năm vào năm 2006 bao gồm Elementis Chromium (công nghiệp sản xuất crom, Castle Hayne, Nam Carolina, Mỹ), Lenzing AG (200 triệu tấn/năm, công nghiệp sản xuất tơ tổng hợp, Lenzing, Áo), Addiseo (Rhodia trước đây, công nghiệp sản xuất methionin, Les Roches-Roussillon, Pháp), Elementis (công nghiệp sản xuất crom, Stockton-on-Tees, Mỹ), Shikoku Chemicals (Tokushima, Nhật Bản) và Visko-R (công nghiệp sản xuất tơ tổng hợp, Nga).
Ứng dụng
Công nghiệp hàng hóa toàn cầu
Với giá cả ở Mỹ là 30 USD/tấn vào năm 1970, từ 6 đến 90 USD/tấn cho chất lượng bánh muối và 130 USD/tấn cho chất lượng cao hơn, natri sunfat là một vật liệu rất phổ biến. Ứng dụng chính làm chất độn trong các loại thuốc tẩy quần áo tại nhà dạng bột, chiếm khoảng 50% sản phẩm được sản xuất. Tuy nhiên, ứng dụng này đang giảm dần do sự chuyển đổi của người tiêu dùng sang loại chất tẩy dạng lỏng hoặc dạng rắn không chứa natri sunfat.
Một ứng dụng khác trước đây của natri sunfat, đặc biệt ở Mỹ và Canada, là trong quá trình Kraft để sản xuất bột giấy. Các chất hữu cơ có trong 'nước đen' thải ra từ quá trình này được đốt để sản xuất nhiệt, cần chuyển đổi natri sunfat thành natri sulfat. Tuy nhiên, quá trình này đang dần được thay thế bằng các phương pháp mới hơn; việc sử dụng natri sunfat trong công nghiệp sản xuất bột giấy ở Mỹ và Canada giảm từ 1.4 triệu tấn/năm vào năm 1970 xuống còn khoảng 150,000 tấn vào năm 2006.
Công nghiệp sản xuất thủy tinh cũng là một ứng dụng quan trọng khác của natri sunfat, đặc biệt là ở châu Âu. Natri sunfat được sử dụng làm chất làm sạch để loại bỏ bọt khí nhỏ từ thủy tinh nóng chảy, và ngăn ngừa quá trình tạo bọt trong quá trình tinh chế. Công nghiệp sản xuất thủy tinh ở châu Âu tiêu thụ khoảng 110,000 tấn mỗi năm trong giai đoạn 1970-2006.
Natri sunfat đóng vai trò quan trọng trong sản xuất vải, đặc biệt là ở Nhật Bản, nơi nó được sử dụng rộng rãi nhất. Natri sunfat giúp làm phẳng và loại bỏ điện tích âm trên sợi vải để thuốc nhuộm có thể thấm sâu hơn. Khác với natri chloride, nó không gây ăn mòn các bình nhuộm bằng thép không gỉ. Ứng dụng này tiêu thụ khoảng 100,000 tấn vào năm 2006 ở Mỹ và Nhật Bản.
Trữ nhiệt
Năng lượng cực cao khi chuyển từ dạng rắn sang lỏng và nhiệt độ chuyển pha 32 °C (90 °F) làm vật liệu này lý tưởng để lưu giữ nhiệt mặt trời và phát hành nó trong các ứng dụng nhiệt không gian. Vật liệu này có thể được tạo thành từ các tấm ngói nhiệt ở gác thượng hoặc từ các tấm pin bao quanh nước nóng bởi mặt trời. Sự chuyển pha giúp giảm khối lượng vật liệu cần thiết để lưu giữ nhiệt một cách hiệu quả (nhiệt nóng chảy của natri sunfat đecahiđrat là 25.53 kJ/mol hay 252 kJ/kg), với lợi thế từ tính đồng bộ hóa nhiệt độ trong pha thích hợp.
Đối với ứng dụng làm mát, một hỗn hợp với muối NaCl thông thường giảm nhiệt độ nóng chảy xuống còn 18 °C (64 °F). Nhiệt nóng chảy của NaCl.Na2SO4·10H2O, tăng lên thành 286 kJ/kg.
Ứng dụng quy mô nhỏ
Trong phòng thí nghiệm, natri sunfat khan thường được sử dụng như chất làm khô trơ để loại bỏ nước khỏi các chất lỏng hữu cơ. Nó hoạt động hiệu quả nhưng chậm hơn so với magie sulfat. Natri sunfat có tác dụng dưới 30 °C và có thể sử dụng với nhiều loại chất liệu nhờ tính trơ hóa học của nó. Thêm natri sunfat vào dung dịch cho đến khi các tinh thể không còn vón cục nữa; hai video clip (xem trên) sẽ giải thích cách các tinh thể vón cục khi bị ẩm, một số tinh thể sẽ tự do khi mẫu chất được làm khô hoàn toàn.
Muối Glauber, đecahiđrat, từng được sử dụng như thuốc nhuận tràng và có hiệu quả trong việc loại bỏ các loại thuốc như acetaminophen ra khỏi cơ thể sau khi dùng quá liều.
Vào năm 1953, natri sunfat được đề xuất để lưu giữ nhiệt trong các hệ thống nhiệt mặt trời passively. Điều này dựa trên tính tan đặc biệt và nhiệt kết tinh cao của nó (78.2 kJ/mol).
Các ứng dụng khác bao gồm làm tan băng trên kính, sử dụng trong chất làm thơm thảm, sản xuất bột hồ, và sử dụng như phụ gia trong thức ăn gia súc.
Gần đây, natri sunfat đã được chứng minh hiệu quả trong quá trình hòa tan vàng từ các sản phẩm điện tử chứa các linh kiện mạ vàng như pin và các bộ chuyển mạch khác. Nó an toàn hơn và giá rẻ hơn so với các hóa chất thử nghiệm khác được sử dụng trong tái chế vàng, với rất ít lo lắng về phản ứng phụ hoặc tác động đến sức khỏe.
Ít nhất một công ty, ThermalTake, đã sản xuất tấm tản nhiệt cho laptop (iXoft Notebook Cooler) sử dụng natri sunfat đecahiđrat trong lõi tấm nhựa. Vật liệu chuyển từ thể rắn sang lỏng và xoay vòng, giúp điều chỉnh nhiệt độ của laptop và làm vật cách nhiệt.
An toàn
Mặc dù natri sunfat nói chung được cho là không độc hại, vẫn cần sử dụng cẩn thận. Bụi có thể gây ra các vấn đề như hen suyễn tạm thời hoặc kích ứng mắt; nguy cơ này có thể được giảm thiểu bằng cách sử dụng bảo hộ mắt và khẩu trang giấy. Vận chuyển không bị hạn chế, và không có nhóm nguy hại hoặc nhóm an toàn nào được xếp loại.
Chú thích
Liên kết ngoài
- Các bộ tính toán: căng bề mặt, khối lượng riêng, nồng độ mol và molal của natri sunfat trong dung dịch nước
Chất bổ sung vi khoáng (A12) |
|---|
Hợp chất natri | |
|---|---|
| Hợp chất vô cơ |
|
| Hợp chất hữu cơ |
|
Hợp chất chứa nhóm chức Sulfat (SO2− 4) |
|---|
| H 2SO 4 |
He | ||||||||||||||||||||
| Li 2SO 4 |
BeSO 4 |
B 2S 2O 9 -BO3 +BO3 |
esters ROSO− 3 (RO) 2SO 2 +CO3 +C2O4 |
(NH 4) 2SO 4 [N 2H 5]HSO 4 (NH 3OH) 2SO 4 NOHSO4 +NO3 |
HOSO4 | +F | Ne | ||||||||||||||
| Na2SO4 NaHSO4 |
MgSO4 | Al2(SO4)3 Al2SO4(OAc)4 |
Si | +PO4 | SO2− 4 HSO3HSO4 (HSO4)2 +SO3 |
+Cl | Ar | ||||||||||||||
| K2SO4 KHSO4 |
CaSO4 | Sc2(SO4)3 | TiOSO4 | VSO4 V2(SO4)3 VOSO4 |
CrSO4 Cr2(SO4)3 |
MnSO4 | FeSO4 Fe2(SO4)3 |
CoSO4 Co2(SO4)3 |
NiSO4 Ni2(SO4)3 |
CuSO4 Cu2SO4 [Cu(NH3)4(H2O)]SO4 |
ZnSO4 | Ga2(SO4)3 | Ge | As | +SeO3 | Br | Kr | ||||
| RbHSO4 Rb2SO4 |
SrSO4 | Y2(SO4)3 | Zr(SO4)2 | Nb2O2(SO4)3 | MoO(SO4)2 MoO2(SO4) |
Tc | Ru(SO4)2 | Rh2(SO4)3 | PdSO4 | Ag2SO4 AgSO4 |
CdSO4 | In2(SO4)3 | SnSO4 Sn(SO4)2 |
Sb2(SO4)3 | Te | +IO3 | Xe | ||||
| Cs2SO4 CsHSO4 |
BaSO4 | * | Lu2(SO4)3 | Hf | Ta | WO(SO4)2 | Re2O5(SO4)2 | OsSO4 Os2(SO4)3 Os(SO4)2 |
IrSO4 Ir2(SO4)3 |
Pt2(SO4)5 | AuSO4 Au2(SO4)3 |
Hg2SO4 HgSO4 |
Tl2SO4 Tl2(SO4)3 |
PbSO4 Pb(SO4)2 |
Bi2(SO4)3 | PoSO4 Po(SO4)2 |
At | Rn | |||
| Fr | RaSO4 | ** | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| * | La2(SO4)3 | Ce2(SO4)3 Ce(SO4)2 |
Pr2(SO4)3 | Nd2(SO4)3 | Pm2(SO4)3 | Sm2(SO4)3 | EuSO4 Eu2(SO4)3 |
Gd2(SO4)3 | Tb2(SO4)3 | Dy2(SO4)3 | Ho2(SO4)3 | Er2(SO4)3 | Tm2(SO4)3 | Yb2(SO4)3 | |||||||
| ** | Ac2(SO4)3 | Th(SO4)2 | Pa | U2(SO4)3 U(SO4)2 UO2SO4 |
Np(SO4)2 | Pu(SO4)2 | Am2(SO4)3 | Cm2(SO4)3 | Bk | Cf2(SO4)3 | Es | Fm | Md | No | |||||||
