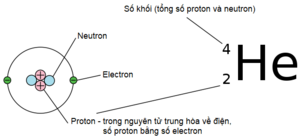
Số nguyên tử hoặc số proton, số hiệu nguyên tử (ký hiệu Z) của một nguyên tố hóa học là số proton trong hạt nhân nguyên tử. Nó đồng thời là số điện tích của hạt nhân. Số nguyên tử xác định duy nhất một nguyên tố hóa học. Trong nguyên tử không tích điện, số nguyên tử cũng là số electron.
Tổng số proton Z và neutron N bằng số khối A của nguyên tử. Vì proton và neutron có khối lượng tương đương (khối lượng electron không đáng kể), khối lượng nguyên tử của bất kỳ nguyên tử nào, khi tính bằng đơn vị khối lượng nguyên tử, nằm trong khoảng 1% của tổng số A.
Các nguyên tử có cùng số proton Z nhưng khác số neutron N và do đó khác khối lượng gọi là các đồng vị. Hơn một phần ba các nguyên tố tự nhiên tồn tại dưới dạng hỗn hợp đồng vị (xem các nguyên tố đơn đồng vị), và khối lượng trung bình của hỗn hợp đồng vị (khối lượng nguyên tử tương đối) xác định khối lượng nguyên tử tiêu chuẩn của nguyên tố đó trên Trái Đất. Trong lịch sử, các nhà hóa học thế kỷ 19 đo lường khối lượng nguyên tử của các nguyên tố so với hydro.
Ký hiệu Z bắt nguồn từ tiếng Đức Zahl nghĩa là số, trước khi tổng hợp các ý tưởng hiện đại từ hóa học và vật lý, biểu thị vị trí số của một nguyên tố trong bảng tuần hoàn. Thứ tự này gần đúng nhưng không hoàn toàn phù hợp với trọng lượng nguyên tử. Sau năm 1915, khi có bằng chứng cho thấy số Z này cũng là điện tích hạt nhân, từ tiếng Đức Atomzahl cho số nguyên tử được sử dụng phổ biến.
Lịch sử phát triển
Bảng tuần hoàn và số thứ tự của mỗi nguyên tố

Nói chung, việc tạo ra một bảng các nguyên tố theo chu kỳ thiết lập trật tự của các nguyên tố, cho phép chúng được đánh số theo thứ tự.
Dmitri Mendeleev tuyên bố rằng ông đã sắp xếp bảng tuần hoàn đầu tiên của mình (xuất bản lần đầu vào ngày 6 tháng 3 năm 1869) theo thứ tự trọng lượng nguyên tử ('Atomgewicht'). Tuy nhiên, sau khi xem xét các tính chất hóa học của các nguyên tố, ông đã thay đổi thứ tự và đặt tellua (trọng lượng nguyên tử 127,6) trước iod (trọng lượng nguyên tử 126,9). Vị trí này phù hợp với thông lệ hiện đại về sắp xếp các nguyên tố theo số proton Z, mặc dù số đó không được biết hoặc còn đang nghi ngờ vào thời điểm đó.
Việc đánh số đơn giản theo vị trí trong bảng tuần hoàn không bao giờ hoàn toàn thỏa đáng. Ngoài trường hợp iod và telluri, một số cặp nguyên tố khác (như argon và kali, cobalt và nickel) có trọng lượng nguyên tử gần giống nhau hoặc đảo ngược, yêu cầu vị trí của chúng trong bảng tuần hoàn phải được xác định bởi tính chất hóa học. Sự xác định dần dần các nguyên tố họ lanthan với tính chất hóa học tương tự, và số nguyên tử không rõ ràng, dẫn đến sự không nhất quán và không chắc chắn trong việc đánh số các nguyên tố ít nhất từ luteti (nguyên tố 71) trở đi (hafni chưa được biết đến vào thời điểm đó).

Mô hình Rutherford-Bohr và van den Broek
Năm 1911, Ernest Rutherford đề xuất một mô hình nguyên tử với lõi trung tâm chứa phần lớn khối lượng và mang điện tích dương, tương đương khoảng một nửa trọng lượng nguyên tử, tính theo đơn vị điện tích của electron. Điện tích trung tâm này xấp xỉ một nửa trọng lượng nguyên tử, mặc dù có sự chênh lệch khoảng 25% so với số nguyên tử vàng (Z = 79, A = 197), nguyên tố duy nhất mà Rutherford dự đoán. Mặc dù Rutherford ước tính điện tích trung tâm của vàng khoảng 100 (nhưng vàng là nguyên tố Z = 79 trên bảng tuần hoàn), một tháng sau khi bài báo của Rutherford xuất hiện, Antonius van den Broek chính thức đề xuất rằng điện tích trung tâm và số electron trong nguyên tử chính xác bằng vị trí của nó trong bảng tuần hoàn (gọi là số nguyên tố, số nguyên tử và ký hiệu Z). Điều này sau đó đã được chứng minh là đúng.
Thí nghiệm năm 1913 của Moseley
Thí nghiệm được nâng cao đáng kể sau nghiên cứu của Henry Moseley năm 1913. Sau khi thảo luận với Bohr, người cùng phòng thí nghiệm (và đã sử dụng giả thuyết của Van den Broek trong mô hình nguyên tử Bohr), Moseley quyết định kiểm tra trực tiếp giả thuyết của Van den Broek và Bohr bằng cách kiểm tra xem các vạch quang phổ phát ra từ các nguyên tử bị kích thích có phù hợp với định đề của lý thuyết Bohr rằng tần số của các vạch quang phổ tỷ lệ với bình phương của Z hay không.
Để làm điều này, Moseley đo các bước sóng của các chuyển đổi photon trong cùng (đường K và L) được tạo ra bởi các nguyên tố từ nhôm (Z = 13) đến vàng (Z = 79) bằng cách sử dụng các mục tiêu anốt di động trong ống tia X. Căn bậc hai của tần số photon tăng từ mục tiêu này sang mục tiêu khác theo một tiến trình số học. Kết luận (định luật Moseley) là số nguyên tử tương ứng chính xác với điện tích hạt nhân, tức là số nguyên tố Z, với độ lệch một đơn vị cho các đường K trong nghiên cứu của Moseley. Tóm lại, Moseley chứng minh rằng loạt nguyên tố họ lanthan (từ lanthan đến luteti) có đúng 15 nguyên tố, không ít hơn cũng không nhiều hơn, điều này còn rất mới mẻ với hóa học thời đó.
Các nguyên tố bị thiếu
Sau khi Moseley qua đời vào năm 1915, số nguyên tử của tất cả các nguyên tố từ hydro đến uranium (Z = 92) đã được xác định bằng phương pháp của ông. Có bảy nguyên tố (với Z < 92) không được phát hiện và do đó được xem là chưa được khám phá, tương ứng với các số nguyên tử 43, 61, 72, 75, 85, 87 và 91. Từ năm 1918 đến 1947, tất cả bảy nguyên tố còn thiếu này đã được tìm thấy. Cùng lúc này, bốn nguyên tố vượt quá uranium đầu tiên cũng đã được khám phá, hoàn thiện bảng tuần hoàn không còn khoảng trống cho đến nguyên tố curium (Z = 96).
Các proton và ý tưởng về các electron trong hạt nhân
Năm 1915, lý do tại sao điện tích hạt nhân tính theo đơn vị Z, hiện được biết là giống với số nguyên tử, vẫn chưa được hiểu rõ. Một ý tưởng cũ được gọi là giả thuyết của Prout cho rằng tất cả các nguyên tố đều được tạo thành từ dư lượng của nguyên tố hydro nhẹ nhất, trong mô hình Bohr-Rutherford với một electron và một điện tích hạt nhân. Tuy nhiên, từ năm 1907, Rutherford và Thomas Royds đã chứng minh rằng các hạt alpha, mang điện tích +2, là hạt nhân của nguyên tử heli, có khối lượng gấp bốn lần hydro, không phải hai lần. Nếu giả thuyết của Prout là đúng, thì phải có một yếu tố nào đó trung hòa một phần điện tích của hạt nhân hydro trong các nguyên tử nặng hơn.
Năm 1917, Rutherford đã thành công trong việc tạo ra hạt nhân hydro từ phản ứng hạt nhân giữa các hạt alpha và khí nitơ, tin rằng ông đã chứng minh định luật của Prout. Ông gọi các hạt nhân nặng mới này là proton vào năm 1920 (các tên khác là prouton và prototype). Công trình của Moseley đã cho thấy rõ ràng rằng hạt nhân của các nguyên tử nặng có khối lượng lớn hơn gấp đôi so với dự đoán từ các hạt nhân hydro, do đó cần có một giả thuyết về sự trung hòa của các proton dư thừa trong tất cả các hạt nhân nặng. Một hạt nhân heli được cho là bao gồm bốn proton và hai 'electron hạt nhân' (electron nằm trong hạt nhân) để cân bằng hai điện tích dương. Ở đầu kia của bảng tuần hoàn, hạt nhân vàng có khối lượng gấp 197 lần hydro được cho là chứa 118 electron hạt nhân để đạt được điện tích còn lại +79, phù hợp với số nguyên tử của nó.
Việc phát hiện ra neutron biến Z thành số proton
Tất cả các lý thuyết về electron trong hạt nhân đã kết thúc khi James Chadwick phát hiện ra neutron vào năm 1932. Một nguyên tử vàng giờ đây được xem là chứa 118 neutron thay vì 118 electron hạt nhân, và điện tích dương của nó được xác định là do 79 proton tạo thành. Vì vậy, từ năm 1932 trở đi, số nguyên tử Z của một nguyên tố được hiểu là số proton trong hạt nhân của nó.
Tính chất hóa học của các nguyên tố
Mỗi nguyên tố sở hữu một tập hợp các tính chất hóa học đặc trưng, kết quả của số lượng electron trong một nguyên tử trung hòa, tương ứng với Z (số nguyên tử). Cấu hình của các electron này tuân theo các quy luật của cơ học lượng tử. Số lượng electron trong các lớp vỏ electron của mỗi nguyên tố, đặc biệt là lớp vỏ hóa trị ngoài cùng, quyết định hành vi liên kết hóa học của nó. Vì vậy, số nguyên tử là yếu tố xác định tính chất hóa học của một nguyên tố; và đây là lý do một nguyên tố được định nghĩa là: 'Tập hợp các nguyên tử có cùng số hiệu nguyên tử hay số đơn vị điện tích hạt nhân'.
Nguyên tố mới và các nghiên cứu
Việc khám phá các nguyên tố mới thường dựa trên số nguyên tử. Từ năm 2010, tất cả các nguyên tố có số nguyên tử từ 1 đến 118 đã được quan sát thấy. Việc tổng hợp các nguyên tố mới được thực hiện bằng cách bắn phá các nguyên tử mục tiêu của các nguyên tố nặng bằng các ion, sao cho tổng số nguyên tử của các nguyên tố mục tiêu và ion bằng với số nguyên tử của nguyên tố mới được tạo ra. Thông thường, chu kỳ bán rã của các nguyên tố càng ngắn khi số nguyên tử tăng, dù có thể tồn tại 'hòn đảo của sự ổn định' đối với các đồng vị chưa được khám phá với số lượng proton và neutron nhất định.
