
| Natri oxide | |
|---|---|
Natri oxide | |
Natri oxide | |
| Danh pháp IUPAC | Natri oxide |
| Tên khác | Đinatri oxide |
| Nhận dạng | |
| Số CAS | 1313-59-3 |
| PubChem | 73971 |
| Thuộc tính | |
| Công thức phân tử | Na2O |
| Khối lượng mol | 61.9789 g/mol |
| Bề ngoài | chất rắn màu trắng |
| Khối lượng riêng | 2.27 g/cm³ |
| Điểm nóng chảy | 1132°C |
| Điểm sôi | 1950 °C (phân huỷ) |
| Độ hòa tan trong nước | phản ứng mãnh liệt tạo ra NaOH |
| Cấu trúc | |
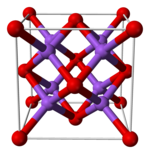
| Cấu trúc tinh thể | Antiflorit (lập phương tâm mặt), cF12 |
| Nhóm không gian | Fm3m, số 225 |
| Tọa độ | tứ diện (Na); lập phương (O) |
| Nhiệt hóa học | |
| Enthalpy hình thành ΔfH298 | −414.2 kJ/mol |
| Entropy mol tiêu chuẩn S298 | 75.1 J mol K |
| Các nguy hiểm | |
| MSDS | ICSC 1653 |
| Chỉ mục EU | không có trong danh sách |
| Nguy hiểm chính | ăn mòn, phản ứng mãnh liệt với nước |
| Điểm bắt lửa | không cháy |
| Các hợp chất liên quan | |
| Anion khác | Natri sulfide Natri selenide Natri teluride |
| Cation khác | Lithi oxide Kali oxide Rubidi oxide Caesi oxide |
| Natri oxide liên quan | Natri peroxide Natri superoxide |
| Hợp chất liên quan | Natri hydroxide |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa).
(cái gì ?)
Tham khảo hộp thông tin | |
Oxit natri là một hợp chất hóa học với công thức Na2O. Nó được sử dụng trong ngành gốm và sản xuất thủy tinh, không phải ở dạng nguyên chất. Khi phản ứng với nước, nó tạo ra natri hydroxit:
- Na2O + H2O → 2 NaOH
Các oxit kim loại kiềm M2O (M = Li, Na, K, Rb) đều có cấu trúc tinh thể kiểu antiflorit. Trong cấu trúc này, các vị trí của anion và cation giống như trong CaF2, với ion natri liên kết theo hình tứ diện với 4 ion oxit, và ion oxit liên kết theo hình lập phương với 8 ion natri.
Phương pháp tổng hợp
Oxit natri được hình thành qua phản ứng giữa natri và natri hydroxide, natri peroxide hoặc natri nitrit:
- 2 NaOH + 2 Na → 2 Na2O + H2
- Na2O2 + 2 Na → 2 Na2O
- 2 NaNO2 + 6 Na → 4 Na2O + N2
Tất cả các phản ứng trên đều liên quan đến việc khử natri với các chất như hydroxide, peroxide hoặc nitrite.
Khi đốt natri trong không khí, sẽ tạo ra Na2O cùng với khoảng 20% natri peroxide Na2O2.
- 6 Na + 2 O2 → 2 Na2O + Na2O2
Ứng dụng
Sản xuất thủy tinh
Oxit natri đóng vai trò quan trọng trong việc sản xuất thủy tinh và các sản phẩm kính khác, thường được đưa vào dưới dạng 'soda' (natri carbonat). Trong thủy tinh, oxit natri không xuất hiện rõ ràng do cấu trúc phức tạp của các polyme liên kết chéo. Thủy tinh thường chứa khoảng 15% oxit natri, 70% silica và 9% vôi (CaOH). Soda natri carbonat giúp giảm nhiệt độ chảy của silica. Thủy tinh soda có điểm nóng chảy thấp hơn và độ đàn hồi cao hơn so với thủy tinh tinh khiết. Sự thay đổi này là do phản ứng giữa silica và soda tạo ra natri silicat với công thức tổng quát Na2[SiO2]x[SiO3].
- Na2CO3 → Na2O + CO2
- Na2O + SiO2 → Na2SiO3
Ghi chú
Liên kết tham khảo
- Thông tin về oxit natri tại Webelements.
- Tờ dữ liệu MSDS bên ngoài Lưu trữ ngày 11 tháng 10 năm 2007 tại Wayback Machine.
Hợp chất natri | |
|---|---|
| Hợp chất vô cơ |
|
| Hợp chất hữu cơ |
|
